Par molekulāri kinētisko teoriju (MKT) sauc teoriju, kas izskaidro procesus, pamatojoties uz priekšstatu, ka viela sastāv no atomiem un molekulām, kas nepārtraukti haotiski kustas. MKT pamato trīs pieņēmumi:
1) jebkura viela sastāv no sīkām daļiņām – molekulām vai atomiem (1. att. a);
2) starp vielas daļiņām vienlaikus darbojas savstarpējas pievilkšanās un atgrūšanās spēki (1. att. b);
3) vielas daļiņas atrodas nepārtrauktā haotiskā kustībā (siltumkustībā) (1. att. c).
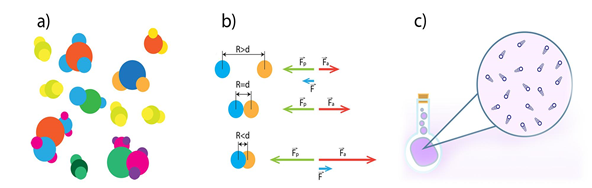
1.att. Molekulāri kinētiskās teorijas pamatpieņēmumu ilustrācija
Jau pats nosaukums „kinētiskā teorija” nosaka, ka tiek aplūkota gāzes daļiņu kustība, jo vārds kinētika ir cēlies no sengrieķu vārda ‘kinētikos’, kas nozīmē „ar kustību saistīts”. Gāzes daļiņas, kustoties kādā noslēgtā tilpumā, ik pa laikam saduras ar trauka sieniņām un rada spiedienu, kā tas jau tika noskaidrots sadaļā par gāzes fizikālajiem parametriem. Gāzes spiedienu noslēgtā sistēmā nosaka šādi raksturlielumi:
1) gāzes daļiņu masa,
2) gāzes daļiņu ātrums,
3) gāzes daļiņu skaits.
Pirmkārt, spiediens ir atkarīgs no tā, cik smagas daļiņas kustas tilpumā (2. att.). Ja ātrums visām daļiņām ir vienāds, lielāku spiedienu uz trauka sieniņām rada smagākā daļiņa.
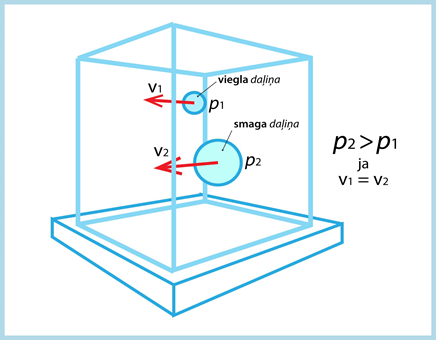
2.att. Daļiņu radītais spiediens ir atkarīgs no to masas
Daļiņas veidotā spiediena lielumu nosaka arī ātrums. Ja vieglāka daļiņa kustēsies ātrāk nekā smagāka (3. att.), tad tā var radīt lielāku spiedienu, ja ir pietiekošs ātruma pārsvars. Savukārt ja smagākai daļiņai ir lielāks ātrums, tas nozīmē, ka tās radītā spiediena lielumu nosaka ne tikai masas, bet arī ātruma atšķirības.
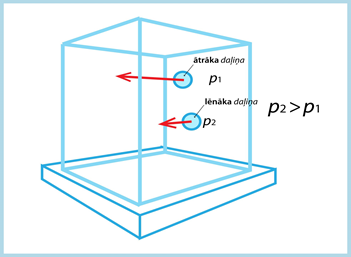
3.att. Daļiņu radītais spiediens ir atkarīgs no to ātruma
Vēl viens nozīmīgs spiedienu noteicošs faktors ir daļiņu skaits. Ir teiciens – „viens nav karotājs”, un to var attiecināt arī uz spiedienu. Ja tilpumā kustas maz daļiņu, tad spiediens ir attiecīgi mazāks nekā gadījumā, ja daļiņu skaits ir liels.
Lai saprastu, kā katrs no raksturlielumiem ietekmē spiediena veidošanas, tuvāk jāapskata spiediena veidošanās mehānisms. 1. attēlā redzama daļiņa, kura noteiktā ātrumā v saduras ar trauka sieniņu. Šo sadursmi raksturo sadursmes laukums S jeb laukums, kurā daļiņa saskaras ar sienu. Sadaļā par impulsu noskaidrojām: notiekot sadursmei, noteiktā laikā momentā ∆t daļiņas impulss izmainās par ∆p. Ja attiecina impulsa izmaiņu pret laiku, kurā tā notikusi, iegūst spēku F, ar kādu daļiņa iedarbojusies uz trauka sieniņu: F =∆p :∆t. Savukārt sadaļā par spiedienu noskaidrojām: ja spēks iedarbojas uz noteiktu laukumu, tad rodas spiediens. Šajā gadījumā laukums, uz kuru iedarbojas F, ir sadursmes laukums, līdz ar to vienas daļiņas radītais spiediens p = F : S.
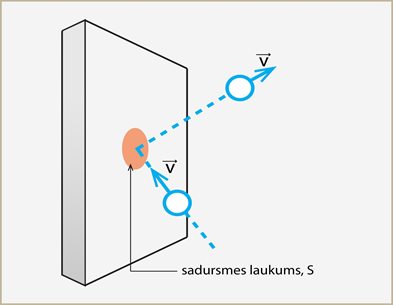
1.att. Spiedienu rada gāzes daļiņu sadursmes ar trauka sienu
Ja novērtē katra gāzes daļiņas raksturlieluma ietekmi uz kopējo radīto spiedienu, kā arī apvieno tos vienā vienādojumā, iegūstp = 1 : 3 m0n(vvid)2, kur
m0– vienas daļiņas masa, kg
n – daļiņu koncentrācija, m-3
vvid– molekulu vidējais kustības ātrums, m2 : s2
Daļiņu koncentrācija n ir daļiņu skaita mērs. Ja vienā un tajā pašā tilpumā vienas daļiņas koncentrācija ir lielāka, tad attiecīgi lielāks ir arī šo daļiņu skaits.
Ātrumam tiek ņemta vidējā vērtība vvid, jo visas gāzes daļiņas nekustas ar vienādu ātrumu, bet to ātrumi ir dažādi (2. att.)
2.att. Gāzes daļiņām ir dažādi ātrumi
Dažādos gāzes daļiņu ātrumus parāda ātruma sadalījums (3. att), kas parāda, ar kādu ātrumu kustas kāda daļa no gāzi veidojošajām daļiņām. Šajā sadalījumā maksimums atbilst visvarbūtīgākajam ātrumam, un tas nozīmē: ja jūs kādai nejauši izvēlētai gāzes daļiņai izmērītu kustības ātrumu, tad vislielākā varbūtība, kas tas būtu tieši šis ātrums. Tomēr jāatceras, ka visvarbūtīgākais ātrums nav tas pats, kas vidējais ātrums. Tā kā sadalījums nav simetrisks, tad vidējais ātrums ir novirzīts uz labo pusi no visvarbūtīgākā ātruma (3. att.).
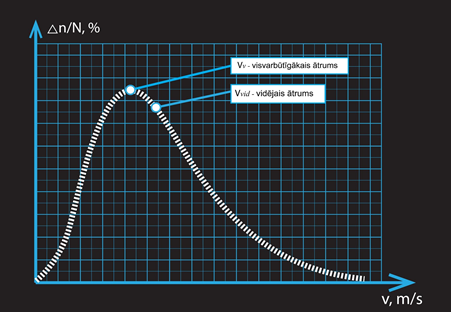
3.att. Gāzes daļiņu sadalījums pēc ātrumiem
Grafika forma ir atkarīga no temperatūras. 4. att. redzams, ka, pieaugot temperatūrai, sadalījums kļūst „plakanāks”, taču izstiepjas pa ātruma x-asi. Tas nozīmē, ka pieaug dažādība gāzes daļiņu kustības ātrumiem, jo nav vairs tik izteikta ātruma „līdera”.
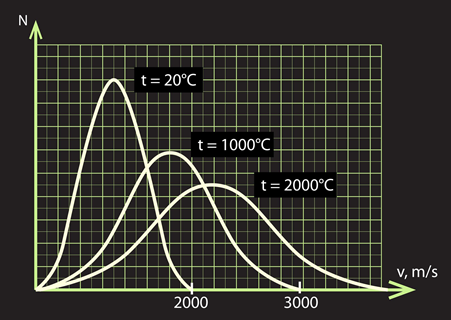
4.att. Gāzes daļiņu ātruma sadalījuma atkarība no temperatūras
Gāzes daļiņu ātruma sadalījuma atkarība no temperatūras nosaka arī to, ka gāzes daļiņu kinētiskā enerģija ir atkarīga no temperatūras, jo kinētiskā enerģija ir atkarīga no daļiņu ātruma. Tā kā daļiņu ātrumu raksturošanai tika izmantots vidējais daļiņu ātrums, tad izmantosim arī vidējo kinētisko enerģiju Evid = 3 : 2kT, kur
k – Bolcmaņa konstante
T – temperatūra
Šāda izteiksme ir spēkā ideālai vienatoma gāzei, kurai katru daļiņu uzskata par masas punktu un neievēro mijiedarbību starp daļiņām (1. att.)
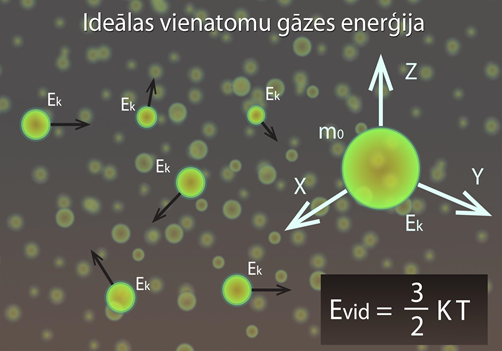
1.att. Ideālas vienatoma gāzes enerģija
Ja gāze ir blīva, turklāt gāzes daļiņas veido vairāki atomi, tad vidējā enerģija ir lielākā nekā ideālas gāzes modelī (2. att.). Tas ir tādēļ, ka daļiņas mijiedarbojas savā starpā. Atšķirībā no ideālas vienatoma gāzes daļiņām, kuras var kustēties trīs savstarpēji neatkarīgos virzienos x, y un z (1. att.), vairākatomu molekula var arī svārstīties un rotēt (2. att.), dodot papildu enerģiju.
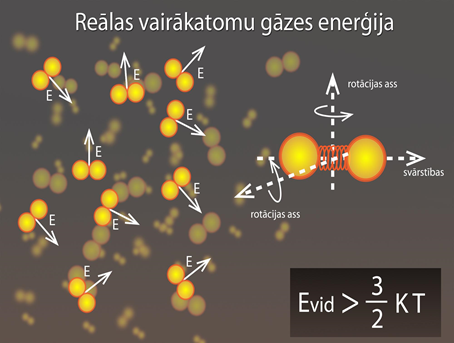
2.att. Reālas vairākatomu gāzes enerģija