Vielas atomārā uzbūve
Šajā nodaļā Tu vari iepazīties ar vielas uzbūves pamatidejām – ar modeli, kuru izmantosim, lai aprakstītu vielas uzbūvi, īpašības un to izpausmes. Aplūkosim kopīgo un atšķirīgo vielas uzbūvē un īpašībās cietā, šķidrā un gāzveida agregātstāvoklī.
Matērija — viela un lauks
Pirms pievērsties vielas uzbūvei, šajā apakšnodaļā Tu vari iepazīties ar vispārējiem priekšstatiem par matēriju un vielu kā vienu no tās formām.
Apkārtējā pasaule, viss, kas pastāv mums apkārt, ir matērija. Matērija ir viss, kas tieši vai netieši ietekmē cilvēka maņas un citus objektus.
Matērijas neatņemama īpašība ir kustība. Bez kustības nav matērijas un otrādi. Matērijas kustība ir jebkuras izmaiņas, kas notiek ar materiāliem objektiem to mijiedarbības rezultātā.
Var aplūkot dažādus matērijas kustības veidus: mehāniskā kustība (ķermeņu relatīvā kustība telpā), atomu un molekulu (haotiskā) siltumkustība, fāžu pārejas starp agregātstāvokļiem (kušana, iztvaikošana ...), radioaktīvā sabrukšana, ķīmiskās un kodolreakcijas, dzīvo organismu un biosfēras attīstība, zvaigžņu, galaktiku un Visuma evolūcija kopumā utt. - tie visi ir dažādu matērijas kustības veidu piemēri.
Par universālām matērijas eksistences un kustības formām pieņemts uzskatīt laiku un telpu.
Dabaszinātnēs izšķir trīs matērijas veidus: viela, fizikālais lauks un vakuums.
Viela ir matērijas veids, ko veido daļiņas, kurām piemīt miera masa (tajā skaitā – protoni, neitroni, elektroni un viss, ko tie veido – atomi un molekulas). Masa nosaka vielas gravitācijas un inerciālās īpašības. Ķīmijā vielas iedala vienkāršās (ar viena ķīmiskā elementa atomiem) un saliktās — ķīmiskajos savienojumos. Vielas īpašības ir atkarīgas no ārējiem apstākļiem un atomu un molekulu mijiedarbības spēka (intensitātes), kas nosaka, piemēram, dažādus vielas agregātstāvokļus: cietu, šķidru un gāzveida.
Fizikālais lauks ir īpašs matērijas veids, kas nodrošina materiālo objektu un to sistēmu mijiedarbību. Pie fizikālajiem laukiem pieder elektromagnētiskie un gravitācijas lauki, kodolspēku lauks, kā arī viļņu (kvantu) lauki, kas atbilst dažādām daļiņām (piem., elektronu–pozitronu lauks). Fizikālo lauku avots ir daļiņas, piemēram, elektromagnētiskajam laukam — uzlādētas daļiņas). Daļiņu radītie fizikālie lauki ar ierobežotu ātrumu pārnes mijiedarbību starp tām.
Viela un lauki atrodas vakuumā, nepārtraukti mijiedarbojoties ar to un viens ar otru. Matērija pastāvīgi pāriet no viena stāvokļa citā, matērija nepazūd un neveidojas, tomēr vielas masa un enerģijas daudzums var mainīties, pārejot viena otrā.
Atomi un molekulas – vielas uzbūves ''pamatelementi''. Molekulāri kinētiskā teorija.
Šajā nodaļā Tu vari iepazīties ar vielas uzbūves pamatidejām – ar modeli, kuru izmantosim, lai aprakstītu vielas uzbūvi, īpašības un to izpausmes.
Ričards Feinmans: „Ja kādā kataklizmā tiktu iznīcinātas visas zinātnes atziņas un tikai viens teikums tiktu nodots nākamajai radību paaudzei, kurš apgalvojums saturētu visvairāk informācijas vismazāk vārdos? Es uzskatu, ka tā ir atomu hipotēze, ka visas lietas ir veidotas no atomiem — mazām daļiņām, kas nepārtraukti pārvietojas, pievelkot viena otru, kad tās atrodas nelielā attālumā, bet atgrūž, kad tās tiek saspiestas viena otrā. Tajā vienā teikumā, jūs redzēsiet, ir milzīgs daudzums informācijas par pasauli, ja pieliek tikai nedaudz iztēles un domāšanas.”
Aprakstot vielas uzbūvi, mēs izmantosim molekulāri kinētisko teoriju (MKT) un tās pamatprincipus:
1. Viela sastāv no sīkām daļiņām. Šīs daļiņas ir vai nu atsevišķi atomi, vai molekulas — stabilas atomu grupas, kam piemīt konkrētās vielas ķīmiskās īpašības. Viena un tā paša elementa atomi ir vienādi. Dažādu elementu atomi ir atšķirīgi. Molekulas var būt veidotas no viena vai vairākiem viena ķīmiskā elementa vai dažādu ķīmisko elementu atomiem. Daļiņas atrodas noteiktos attālumos viena no otras, starp tām ir tukša telpa (1. attēls).
1.att. Atoms un molekula
2. Vielas daļiņas atrodas haotiskā kustībā, kas nekad neapstājas (šo kustību sauc par termisko kustību — siltumkustību).
3. Vielas atomi vai molekulas savstarpēji mijiedarbojas ar pievilkšanās un atgrūšanās spēkiem, kas ir atkarīgi no attālumiem starp daļiņām.
Šie pamatprincipi ir daudzu novērojumu un eksperimentālu faktu vispārinājums. Apskatīsim šos principus tuvāk un sniegsim to eksperimentālu pamatojumu.
Tā, piemēram, H2O ir ūdens molekula, kas sastāv no diviem ūdeņraža H atomiem un viena skābekļa O atoma. Sadalot molekulu atomos, mums vairs nav vielas, ko sauc par "ūdeni". Turklāt, sadalot H un O atomus to sastāvdaļās, mēs iegūstam protonu, neitronu un elektronu kopumu un tādējādi zaudējam informāciju, ka sākotnēji tie bija ūdeņradis un skābeklis.
Atomus un molekulas īsumā sauksim vienkārši par vielas daļiņām. Kas īsti ir šī daļiņa – atoms vai molekula? Ja mēs runājam par ķīmisko elementu, tad atoms būs daļiņa; ja aplūko saliktu vielu, tad tās daļiņa ir molekula, kas sastāv no vairākiem atomiem.
Šīs daļiņas ir tik mazas, ka ar neapbruņotu aci nav saskatāmas, līdz ar to par to eksistenci sākotnēji varēja spriest no netiešiem novērojumiem. Tas bija līdz brīdim, kad pietiekama tehnoloģiju attīstība ļāva atomus un molekulas arī saskatīt (2. attēls). Mazākais izmērs, ko ar neapbruņotu aci var saskatīt, ir 0,00001 m. Atoms ir aptuveni simttūkstoš reižu mazāks, tātad aptuveni 0,0000000001 m jeb 10-10 m (10 nm). Ja mēs iedomātos, ka tāds atoms tiktu palielināts līdz persika izmēram, tad persikam attiecīgi būtu jābūt Zemeslodes izmērā.
Atomu un molekulu masa ir ļoti maza. Piemēram, vienas ūdens molekulas H2O masa ir aptuveni 3\(\cdot\)10-26 kg. Tik mazus lielumus nav ērti izmantot, tādēļ ir ieviesta speciāla mērvienība – atommasas vienība u.
Vienas atommasas vienības vērtība ir vienāda ar 1 : 12 daļu no oglekļa izotopa 12C masas (2. attēls). Atommasas vienību izsakot kilogramos iegūst, ka u = 1,6605655 \(\cdot \)10-27 kg. Piemēram, vienas ūdens molekulas atommasa jeb molekulmasa \(M\) ir vienāda ar 18 atommasas vienībām.

Arī vielas daudzuma mērīšanai ir speciāla mērvienība, jo parasti ir darīšana ar milzīgu vielas daļiņu skaitu. Šajā gadījumā atkal talkā nāk ogleklis. Starptautiskajā mērvienību sistēmā ir pieņemts vielas daudzumu mērīt molos.
Daļiņu skaits vienā molā faktiski ir vienāds ar 12 gramos oglekļa izotopa 12C esošo daļiņu skaitu. Kopš 2019. gada SI pārdefinēšanas ir noteikts, ka viens mols satur 6,022 140 76 · 1023 daļiņas. Šo skaitli sauc par Avogadro skaitli \(N_\mathrm{A}\).
Līdz ar to viena vielas mola masa \(M\) gramos skaitliski vienāda ar atommasu u vienībās.
Mols, tātad, ir skaits – un nav svarīgi, tieši ko skaita. Ar vienu molu viena centa monētu varētu noklāt Zemeslodi aptuveni 300 m biezā kārtā.
Lai varētu noteikt vielas masu zinot tās daudzumu molos, ir jāzina šīs vielas viena mola masa, ko sauc par molmasu \(M\).
Lai aprēķinātu molmasu, ir jāzina vienas daļiņas masa un Avogadro skaitlis: \(M=N_\mathrm{A}\cdot{m_0}\), kur \(m_0\) — vienas molekulas masa. Tagad, ja ir zināma vielas masa un molmasa, var izrēķināt vielas daudzumu molos: \(v=\)\(m\over M\), kur \(v\) – vielas daudzums, \(m\) – vielas masa, bet \(M\) – molmasa.
Piemēram, dzerot kafiju no vidēja izmēra krūzes, tiek patērēts aptuveni 252 g ūdens. Ūdens molmasa ir \(M_\mathrm{ūdens} \)= 18 g/mol. Tādējādi ar vienu kafijas krūzi tiek izdzerts \(v=\)\(m\over M\)\(= 252 : 18 = 14\)mol ūdens jeb aptuveni 84,28 · 1023 ūdens molekulu.
Parādības, kas apstiprina molekulāri kinētisko teoriju
Pirmais MKT pamatprincips saka arī to, ka daļiņas neaizpilda visu telpu. Daļiņas izvietotas diskrēti, it kā atsevišķos telpas punktos. Starp daļiņām ir ''spraugas'', kuru izmērs var mainīties.
Ķermeņu termiskā izplešanās to apliecina: karsējot, palielinās attālumi starp vielas daļiņām un palielinās ķermeņa izmēri. Atdziestot, gluži pretēji, attālumi starp daļiņām samazinās, kā rezultātā ķermenis saraujas (lai gan ir iespējami izņēmumi, kas saistīti ar vielas uzbūvi - tā, piemēram, ūdenim kušanas temperatūras tuvumā no 0 °C līdz 4 °C sasilstot vidējais attālums starp daļiņām samazinās).
Skaidrs apstiprinājums MKT pirmajam un arī otrajam pamatprincipam ir difūzija — saskarē esošo vielu savstarpēja patvaļīga sajaukšanās (lūk video par difūzijas attēlojumu). Piemēram, difūzijas process šķidrumā. Šķīstošas vielas daļiņas iepilina ūdens glāzē augšējā kreisajā daļā (3. attēls). Laika gaitā daļiņas pārvietojas (izkliedējas) no augstas koncentrācijas apgabala uz zemas koncentrācijas apgabalu. Galu galā daļiņu koncentrācija visur kļūst vienāda – daļiņas vienmērīgi sadalās pa visu šķidruma tilpumu. Tas iespējams tikai tad, ja vielu daļiņas kustas un starp tām ir brīva telpa, kur pārvietoties. ''Vērot'' difūziju var, izmantojot PhET simulāciju.
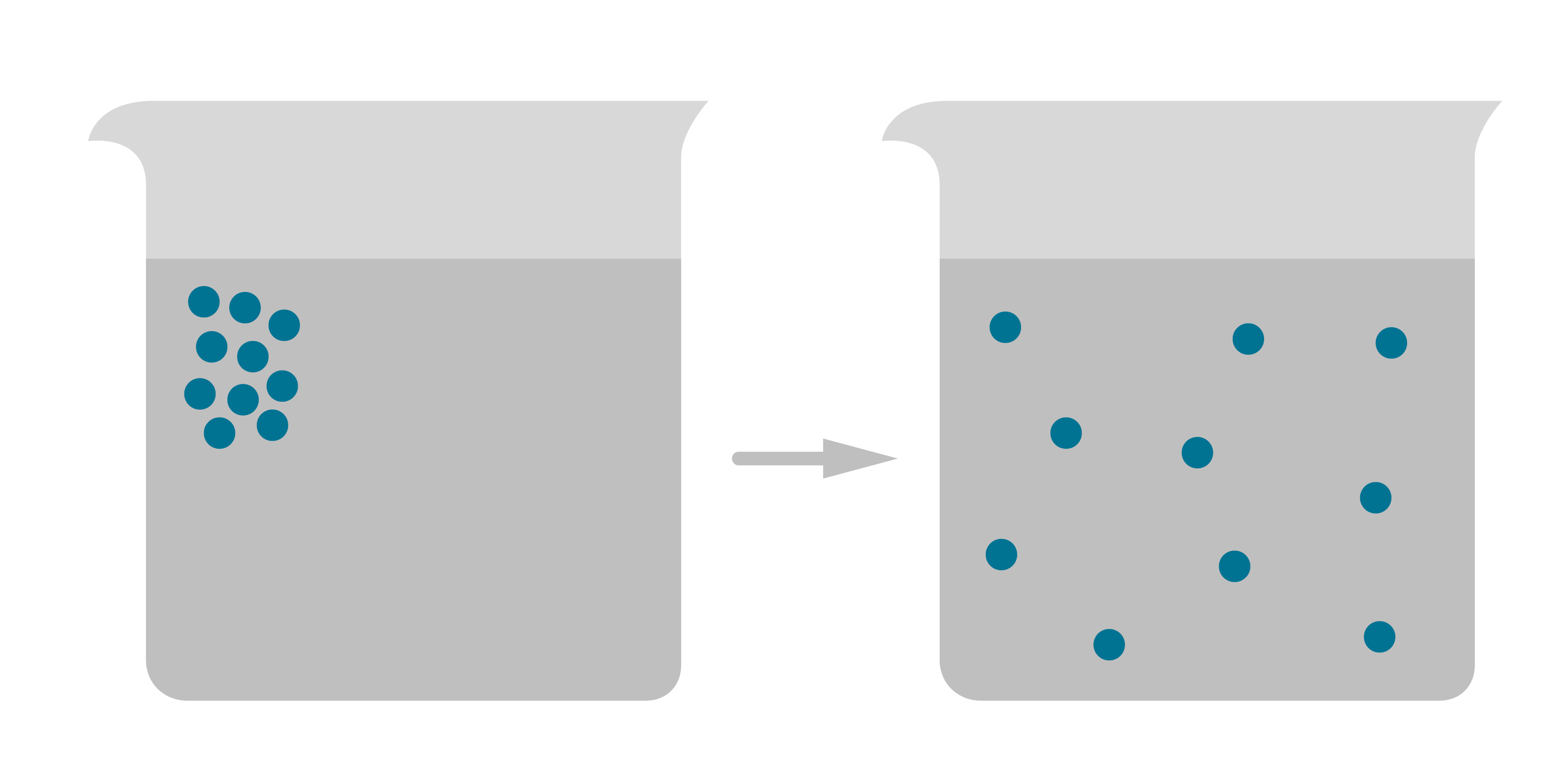
Visātrāk difūzijas process norisinās gāzēs. Par to var pārliecināties, apskatot, piemēram, automašīnas izplūdes gāzes: drīz pēc izplūšanas apkārtējā vidē tās strauji izplatās un nonāk gan augstākos, gan zemākos gaisa slāņos. Arī cietvielās norisinās difūzija, tikai krietni lēnāk nekā gāzēs un šķidrumos, tomēr, palielinot temperatūru un spiedienu, difūzija norit straujāk. Šo faktu izmanto kompozītmateriālu veidošanā, kad dažādi cieti materiāli, pakļauti augstai temperatūrai un spiedienam, difūzijas rezultātā savienojas.
''Klasisks'' apliecinājums pirmajam un otrajam MKT pamatprincipam ir arī Brauna kustība — šķidrumā iemaisītu sīku (apmēram mikrometru diametrā) vielas daļiņu nepārtraukta haotiska kustība, kuras cēlonis — vides daļiņu triecieni. Ja daļiņa ir liela, molekulu triecienu ''summa'' no visām pusēm ir aptuveni vienāda, bet, ja maza — triecieni no dažādām pusēm nekompensējas. Tāpēc Brauna daļiņa kustas pa sarežģītu zigzagveida trajektoriju.
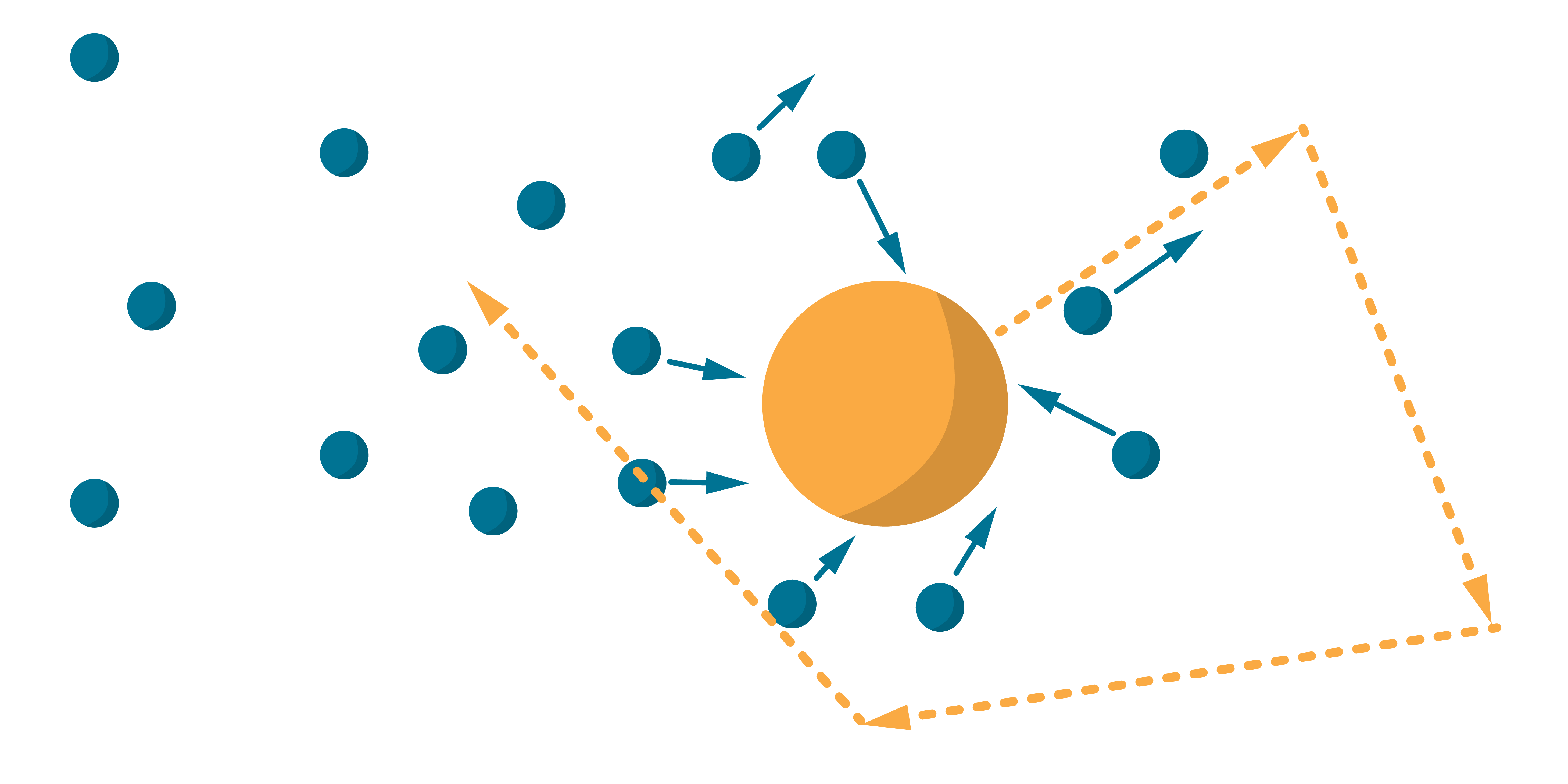
Līdzīgu piemēru ir daudz – pat vērojot peļķi izžūstam, varam secināt, ka ūdens daļiņas ir ļoti mazas (tās nevar saskatīt) un tās, acīmredzot, kustas – ir mainījušas savu atrašanās vietu.
Vielas daļiņu mijiedarbība
MKT trešais pamatprincips ir par vielas daļiņu mijiedarbību: atomi (vai molekulas) savstarpēji mijiedarbojas ar pievilkšanās un atgrūšanas spēkiem, kas ir atkarīgi no attālumiem starp daļiņām: Lielos attālumos ''stiprāki'' ir pievilkšanās spēki, mazos — dominē atgrūšanās spēki.
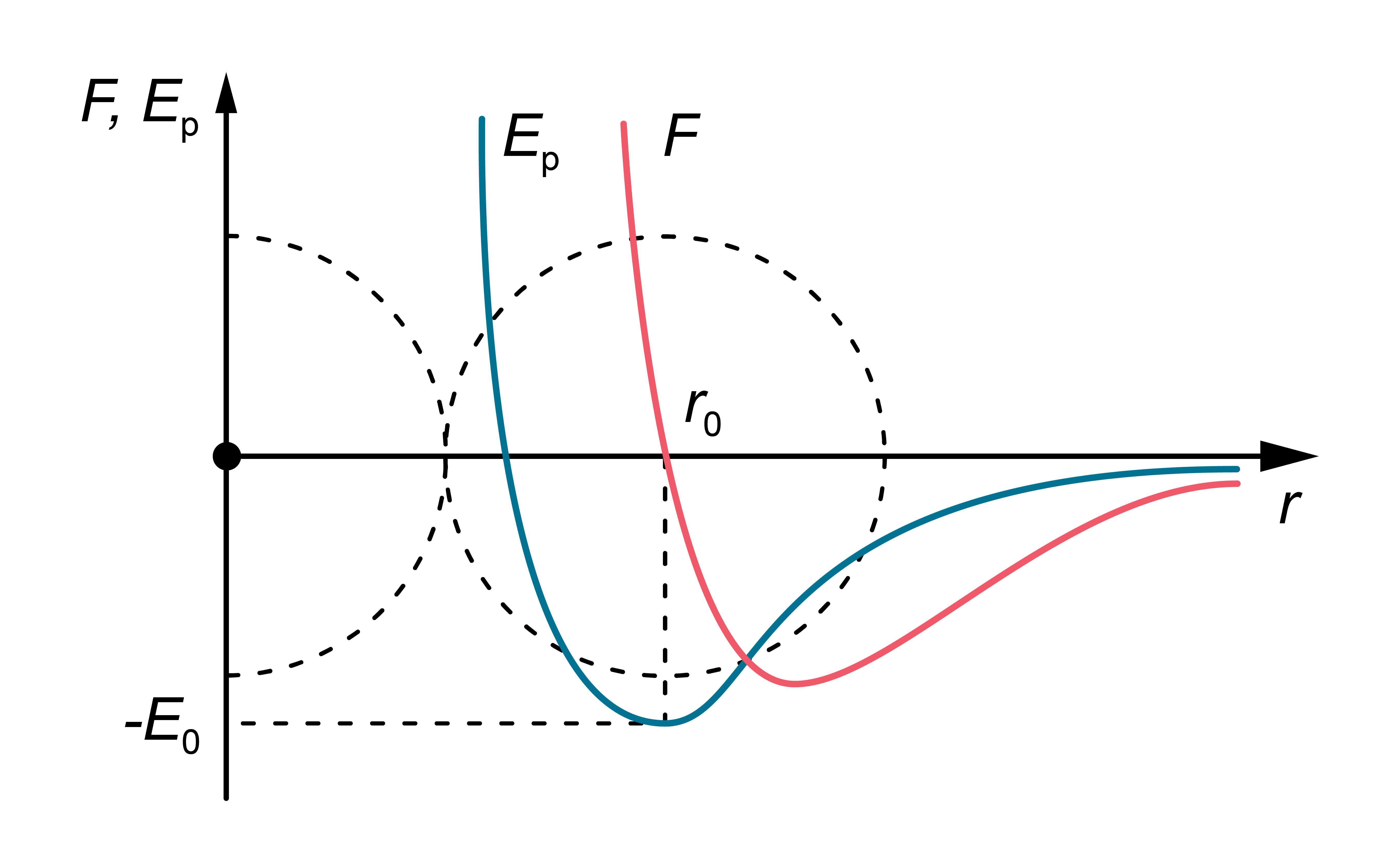
Šie spēki ir elektromagnētiskas dabas – vienas daļiņas (atoma) pozitīvi lādētais kodols pievelk otra atoma elektronus, savukārt, abu atomu kodoli (tāpat arī – abu atomu elektroni) savstarpēji atgrūžas. Vielas vienkāršotā modelī daļiņas pieņemts attēlot kā lodītes, kuru diametru nosaka elektronu izvietojums. To mijiedarbības rezultējošais spēks (\(F\)) ir atkarīgs no attāluma starp vielas daļiņu ''centriem'' (5. attēls).
MKT trešā pamatprincipa pamatotību apliecina elastības spēki, kas rodas ķermeņus deformējot. Kad ķermenis tiek izstiepts, attālumi starp tā daļiņām palielinās, un sāk dominēt daļiņu pievilkšanās spēki. Kad ķermenis tiek saspiests, attālumi starp daļiņām samazinās, un rezultātā virsroku atgrūdošie spēki. Abos gadījumos elastības spēks ir vērsts virzienā, kas ir pretējs deformācijai. Tuvāk to aplūkosim nodaļā "Elastības spēks".
Pats fakts, ka pastāv cieti ķermeņi, kuru daļiņas grūti atdalīt vienu no otras, apliecina mijiedarbības spēku pastāvēšanu.
Tātad — par apstiprinājumu starpmolekulārās mijiedarbības spēku esamībai var uzskatīt arī trīs vielas agregātstāvokļu pastāvēšanu.
Izmantojot vielas uzbūves no daļiņām modeli, ir iespējams izskaidrot tādas parādības, kā siltumvadīšana un termiskā izplešanās, ko tuvāk aplūkosim nodaļā "Termiskā izplešanās".
Temata "Vielas uzbūve" kopsavilkumu skaties arī infografikā.
Cietas vielas, šķidrumi un gāzes
Vielas daļiņu mijiedarbība
Spēki, kas darbojas starp divām daļiņām (atomiem vai molekulām), ir atkarīgi no attāluma starp tām. Šīs daļiņas ir sarežģītas telpiskas struktūras, kas satur gan pozitīvus, gan negatīvus lādiņus. Ja attālums starp molekulām ir pietiekami liels, tad dominē starpmolekulārās pievilkšanās spēki, bet nelielos attālumos stiprāki ir atgrūšanās spēki.
Rezultējošā molekulu mijiedarbības spēka (\(F\)) un molekulu savstarpējās mijiedarbības potenciālās enerģijas (\(E_\mathrm{p}\)) atkarības no attāluma starp to centriem kvalitatīvi parādītas 1. attēlā. Noteiktā attālumā \(r=r_0\) mijiedarbības spēks kļūst vienāds ar nulli – pievilkšanās un atgrūšanās spēki viens otru līdzsvaro. Šo attālumu nosacīti var uzskatīt par vielu veidojošās daļiņas (molekulas) ''diametru''. Mijiedarbības potenciālā enerģija pie \(r=r_0\) ir minimāla – var teikt, ka daļiņas atrodas ''potenciāla bedrē''. Lai atdalītu divas molekulas, kas atrodas attālumā \(r_0\) vienu no otras (līdz bezgalībai), tām jāpiešķir papildu enerģija \(E_0\). Vērtību \(E_0\) sauc par saites enerģiju.
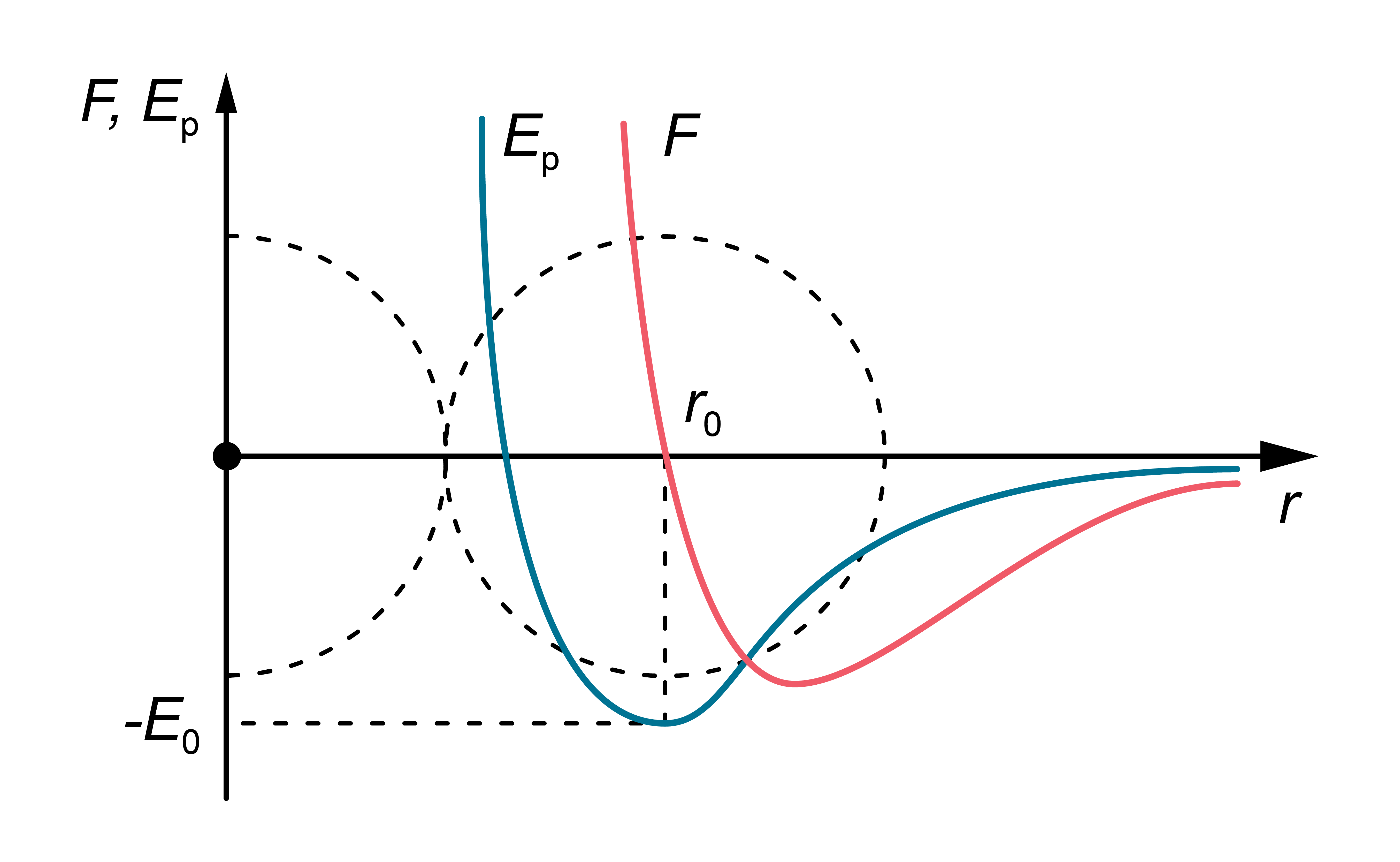
1.att. Daļiņu mijiedarbības rezultējošais spēks un enerģija
Ķīmisku saišu gadījumā, kas veidojas molekulā, potenciālās enerģijas līknei var būt tāda forma, kāda parādīta 2. attēlā a. Joprojām pastāv optimālais attālums, kurā molekula ir stabila . Bet, kad atomi tuvojas no liela attāluma, sākotnēji pārsvarā ir atgrūšanās, nevis pievilkšanās spēki. Atomi neveido saiti spontāni. Sistēmā ir jāievada papildus enerģija, lai tā tiktu pāri ''barjerai''. Šo nepieciešamo enerģiju sauc par aktivācijas enerģiju.
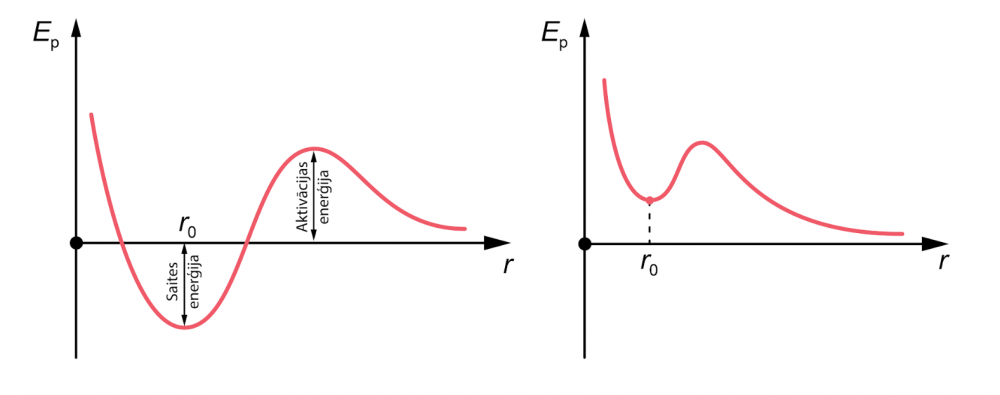
2.att. Atomu mijiedarbības enerģija
Aktivācijas enerģija bieži atspoguļo nepieciešamību pārraut citas saites, pirms var veidoties jaunas. Piemēram, lai izveidotos ūdens molekula H2O, vispirms jāsadala H2 un O2 molekulas atomos, pievadot enerģiju - aktivācijas enerģiju. Tad H un O atomi var apvienoties ūdens molekulā, atbrīvojot daudz vairāk enerģijas, nekā tika ieguldīts sākotnēji.
Savukārt potenciālās enerģijas diagramma jonu saitēm, piemēram, NaCl, būs līdzīga 1. attēlā redzamajai, jo joni pievelk viens otru nedaudz lielākā attālumā nekā r0, bet mazākos attālumos iekšējo elektronu apvalku pārklāšanās rada atgrūšanos.
Dažkārt saites potenciālā enerģija izskatās kā 2. attēlā b. Šajā gadījumā saistītās molekulas enerģija atdalīšanas brīdī ir lielāka nekā tad, ja nav saites – lai izveidotos saite, enerģiju ir jāpievada (tātad saites enerģija ir negatīva), un notiek enerģijas izdalīšanās, kad saiti sarauj. Šāda saite ir stabila tikai tāpēc, ka pastāv barjera - aktivācijas enerģija. Šāda veida saite ir svarīga dzīvās šūnās, jo tā dod iespēju enerģiju efektīvi uzglabāt noteiktās molekulās, (piemēram, adenozīna trifosfāts).
Vielas agregātstāvokļi
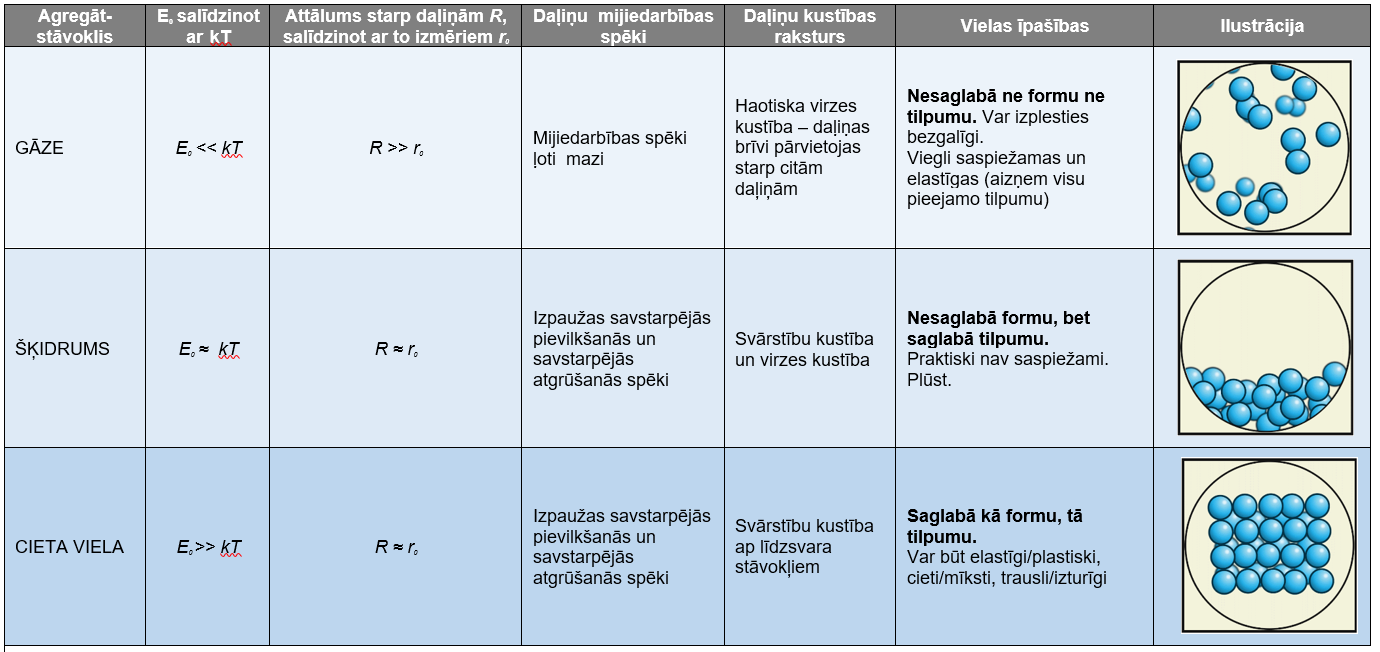
Viela var būt cietā, šķidrā vai gāzveida agregātstāvoklī.
Vielas agregātstāvokļi (no latīņu aggrego - "pievienoju") ir tādi vielas stāvokļi, kuriem mainoties, lēcienveidā mainās vielas īpašības. Vielas agregātstāvokļus nosaka, pamatojoties uz īpašībām, kuras var redzēt vai sajust. Vielu, kas ir cieta un saglabā noteiktu formu, sauc par cietu vielu; vielu, saglabā savu tilpumu, bet plūst, nesaglabā savu formu, sauc par šķidrumu. Vielu, kas var mainīt gan formu, gan tilpumu, sauc par gāzi. Par agregātstāvokli uzskata arī plazmas stāvokli, kurā gāzes nonāk, nemainīgā spiedienā paaugstinoties temperatūrai un jonizējoties.
Šāda agregātstāvokļa definīcija ir pārāk šaura, lai aprakstītu visas iespējas. Tā, piemēram, noteiktos apstākļos lēcienveidā var mainīties cietā stāvoklī esošas dzelzs īpašības – spēja magnētiskajā laukā iegūt paliekošu magnetizāciju. Šķidrie kristāli ir šķidri, bet vienlaikus tiem piemīt arī cietu vielu īpašības, piemēram spēja polarizēt caur tiem ejošo elektromagnētisko starojumu. Pastāv amorfi ķermeņi, kas saglabā šķidruma struktūru, bet tiem piemīt spēja saglabāt formu. Lai aprakstītu šos atšķirīgos stāvokļus, tiek izmantots plašāks termodinamiskās fāzes jēdziens.
Vielas agregātstāvoklis ir atkarīgs no apstākļiem, kādos šī viela atrodas – galvenokārt – temperatūras (\(T\)) un spiediena (\(p\)), jo no šiem apstākļiem ir atkarīga vielas daļiņu kustības vidējā kinētiskā enerģija \(E_\mathrm{K}\)\(_\mathrm{VID}\)~
\(kT\) un daļiņu mijiedarbības potenciālā enerģija \(E_\mathrm{P}\) (saites enerģija \(E_0\)):

Ķīmiskie elementi un to izotopi
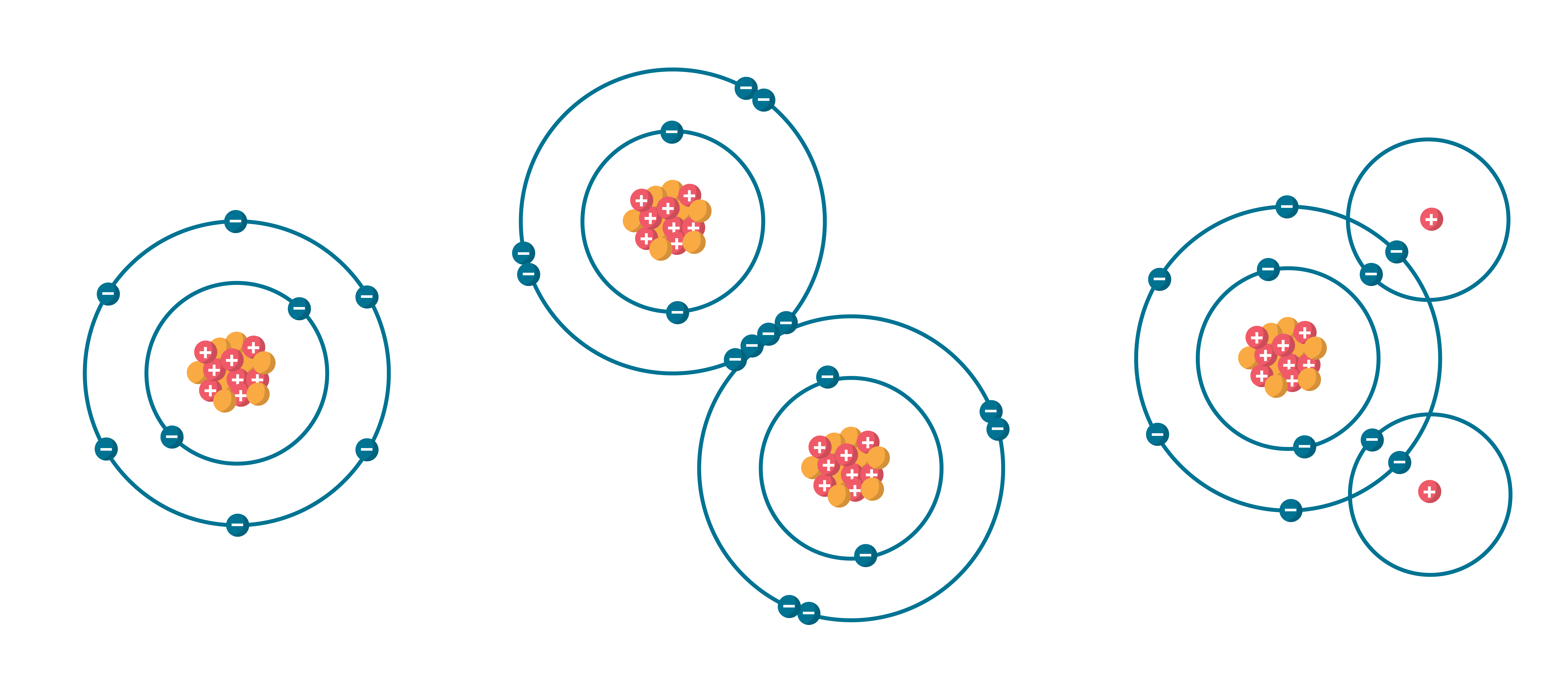
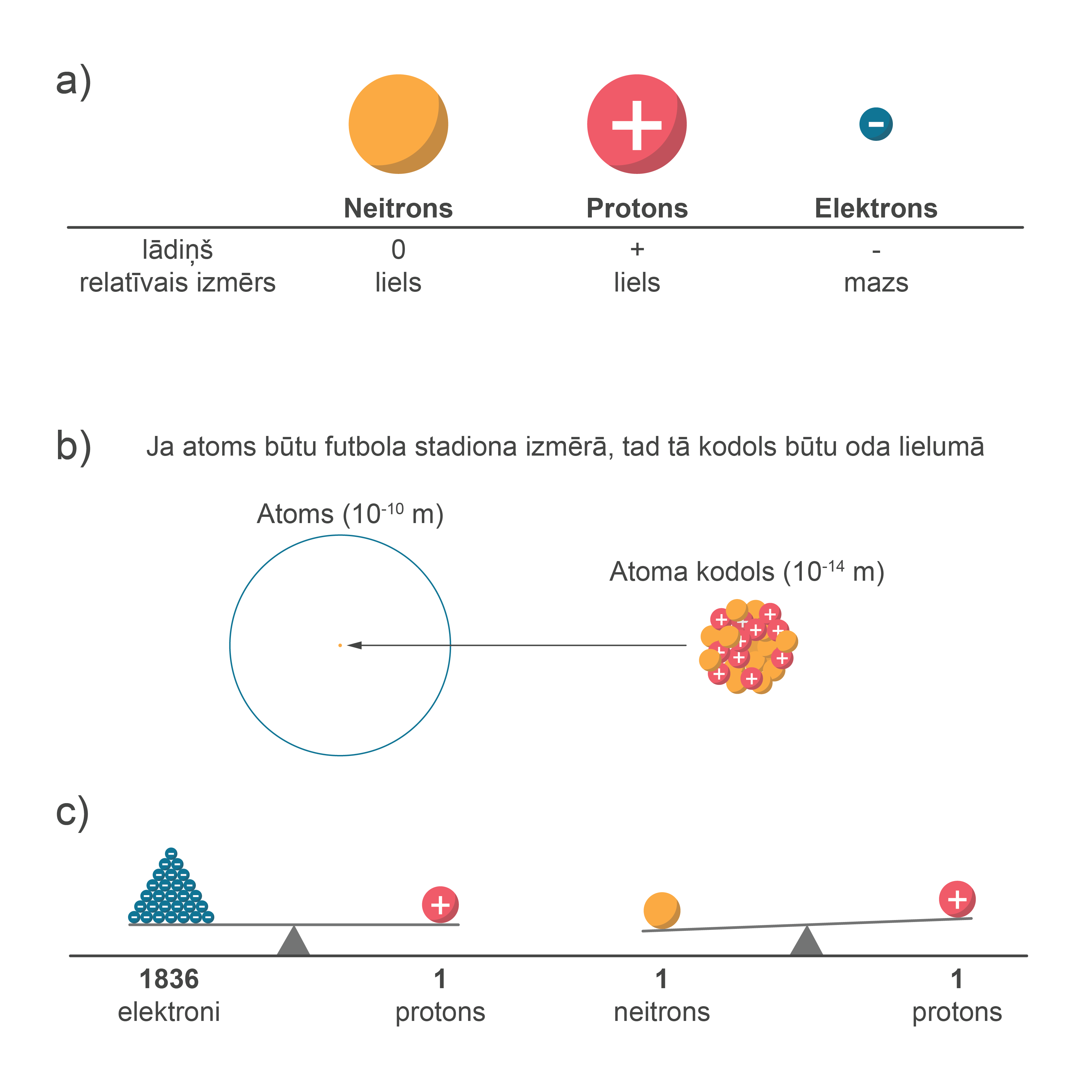
Ķīmisko elementu jeb elementu definē kā materiālu (viena veida atomu kopumu), ko nav iespējams pārveidot citos elementos vai citā vielā, izmantojot ķīmijas metodes. Mazākā ķīmiskā elementa daļiņa ir atoms - ķīmiski nesadalāma daļiņa, kas sastāv no elektriski pozitīvi lādēta kodola un elektroniem. Atoma kodolu veido pozitīvi elektriski lādēti protoni un elektriski neitrāli neitroni. Elementus identificē pēc protonu skaita to atoma kodolā. Negatīvi lādēto elektronu skaits neitrālā atomā ir vienāds ar protonu skaitu atoma kodolā (1. attēls a, 3. attēls tēmā atomu elektronapvalks). Protona lādiņa (elementārlādiņa) skaitliskā vērtība e = 1,6 · 10–19 C, elektronam piemīt tieši tik pat liels negatīvs lādiņš.
Skaties DZM materiālu par šo tematu!
Atoma izmērs ir aptuveni 10-10 m, un kodola izmērs ir tikai aptuveni 10-14 m . Lai gan kodols ir tik mazs, tajā ir koncentrēta gandrīz visa atoma masa, jo kodolu veido no protoni un neitroni, kuru masa ir daudz lielāka par elektronu masu. Viena protona masa ir aptuveni vienāda ar 1836 elektronu masu (1. att. b). Neitrona un protona masa ir aptuveni vienāda (1. att. c).
Šobrīd ir zināmi 118 elementi. Uz Zemes dabā ir atrodami 94 elementi. Jaunu elementu var izveidot, pievienojot atoma kodolam vairāk protonu. Katru ķīmisko elementu raksturo atomskaitlis Z, kas ir vienāds ar protonu skaitu elementa atomu kodolā, piemēram, visos hēlija atomu kodolos ir 2 protoni, tātad tā atomskaitlis ir 2. (2. attēls).
Elementu ķīmiskās īpašības nosaka elektronu skaits un to sadalījums elektronu čaulās.
Ķīmisko elementu periodiskā tabula
Ir izveidota ķīmisko elementu periodiskā tabula, kurā ķīmiskie elementi ir sakārtoti secībā pēc atomskaitļa (protonu skaita kodolā) un atbilstoši elektronu sadalījumam elektronu čaulās.
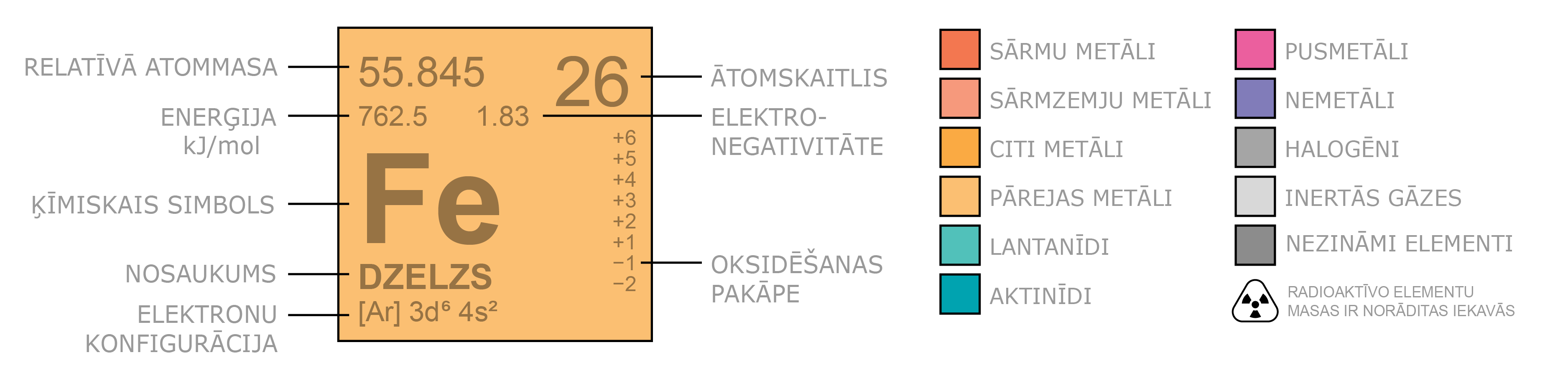
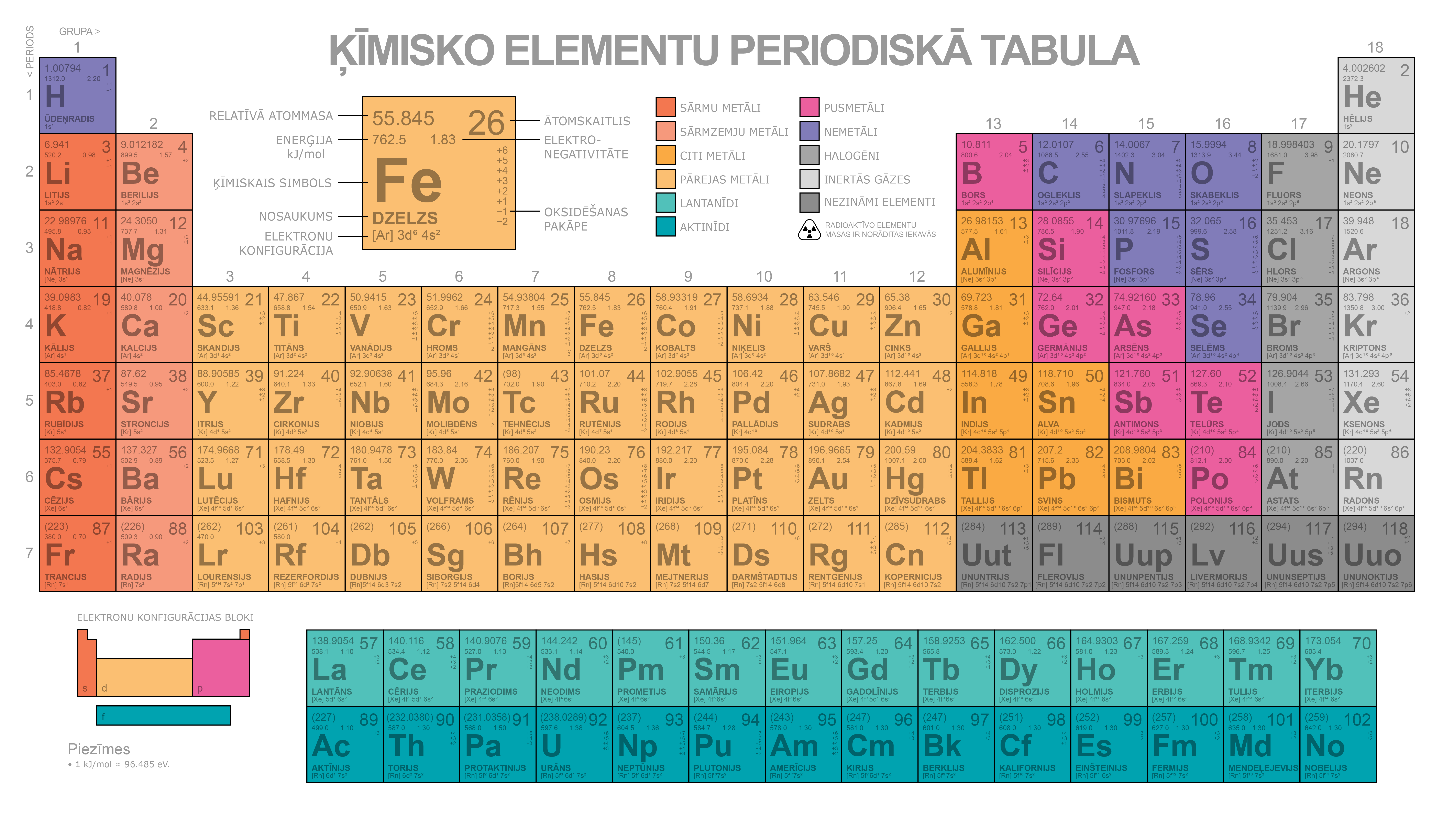
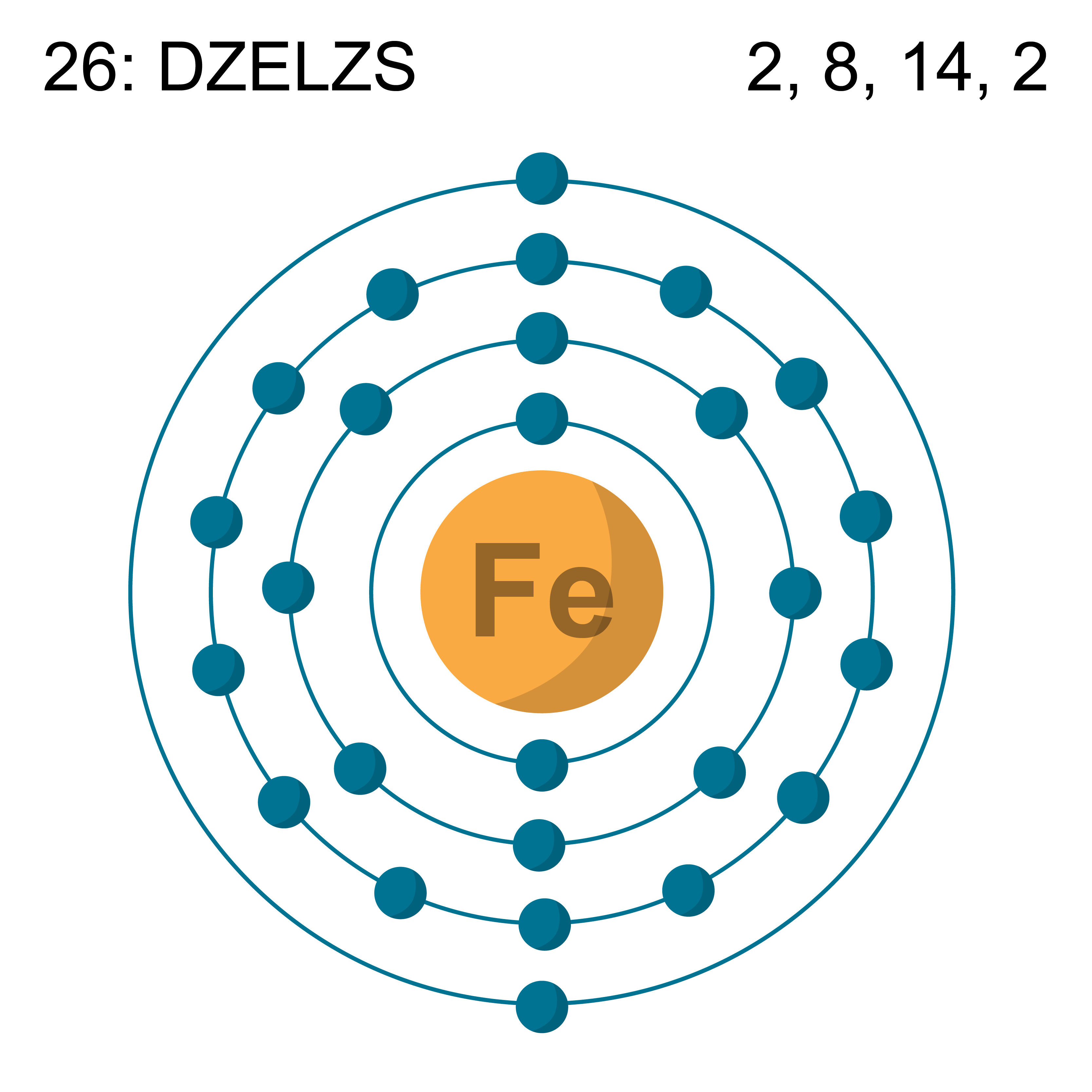
Pieaugot ķīmiskā elementa kārtas skaitlim, pieaug kodolā esošo protonu skaits un elektronu skaits ap to. Ja pirmajam ķīmiskajam elementam – ūdeņradim – ir viens protons un viens elektrons, tad hēlija atoma kodolā ir 2 protoni un 2 neitroni un ap kodolu riņķo 2 elektroni (3. attēls tēmā atoma elektronapvalks).
Neitronu skaits viena un tā paša elementa atomu kodolā var atšķirties.
Atoma elektronapvalks
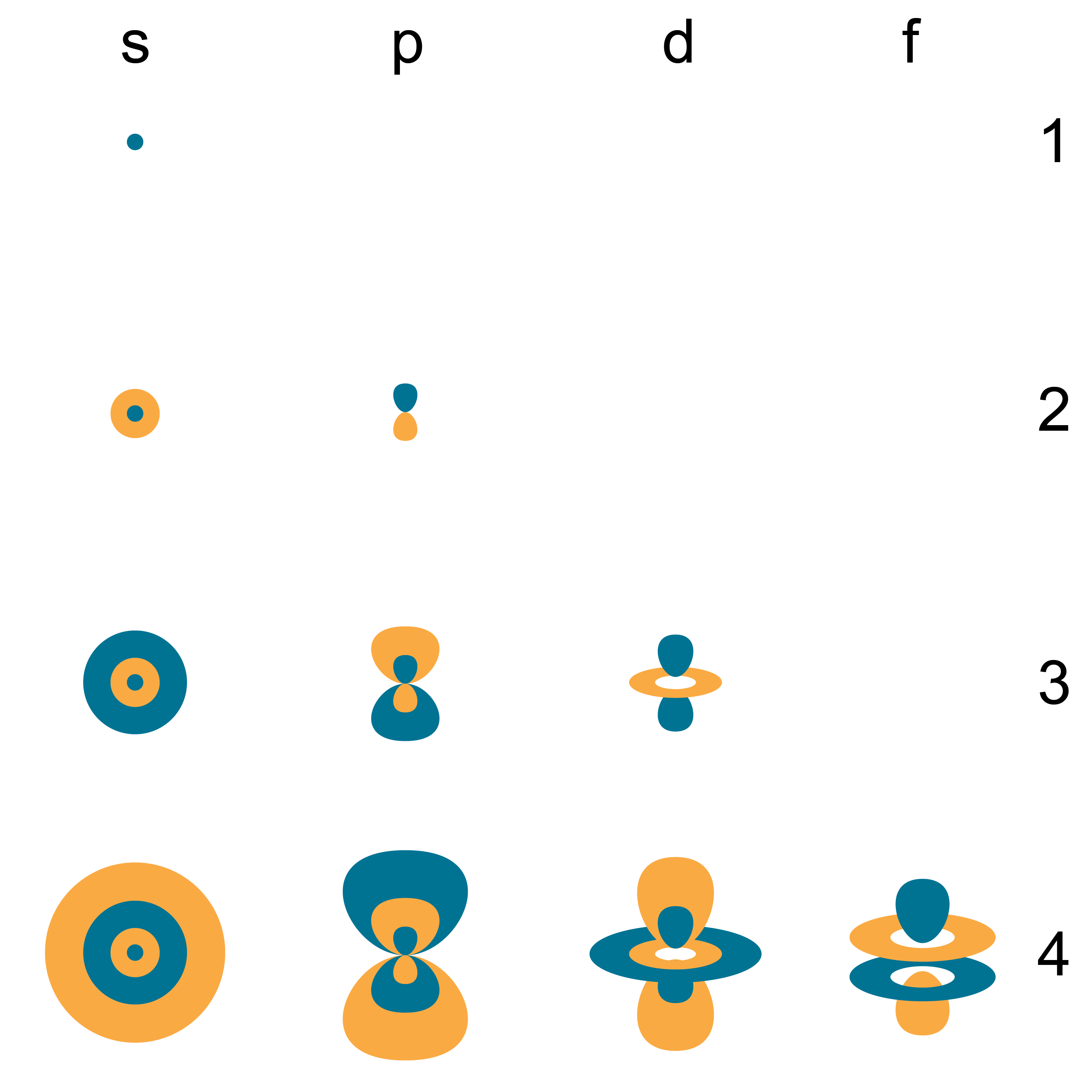
Ķīmijā un atomfizikā elektronapvalku var uzskatīt par sava veida ''orbītu'', kurā elektroni "riņķo" ap atoma kodolu. Kodolam tuvāko apvalku sauc par "1 apvalku" (sauktu arī par "K apvalku"), tam seko "2 apvalks" (vai "L apvalks"), tad "3 apvalks" (vai "M apvalks"). ), utt. arvien tālāk no kodola. Elektronpvalki atbilst galvenajiem kvantu skaitļiem (n = 1, 2, 3, 4 ...) vai ir apzīmēti alfabētiskā secībā ar burtiem, ko izmanto rentgenstarojuma apzīmējumos (K, L, M, ...).
Katrā apvalkā var būt tikai noteikts skaits elektronu: pirmajā apvalkā var būt līdz diviem elektroniem, otrajā apvalkā var būt līdz 8 (2 + 6) elektroniem, trešajā apvalkā var būt līdz 18 (2 + 6 + 10) utt. n-tajā apvalkā var būt līdz 2 n² elektronu.
Katrs elektronapvalks sastāv no viena vai vairākiem apakšapvalkiem (s, p, d, f, g), un katrs apakšapvalks sastāv no vienas vai vairākām atomu orbitālēm (1. attēlā)
Šo sadalījumu skaidro kvantu mehānika.
Elektronu sadalījums pa apvalkiem (piemēram, dzelzs atomam 2. attēlā) atspoguļojas periodiskajā tabulā (2. attēls tēmā ķīmiskie elementi un to izotopi).
Atomus, kuriem ir vienāds protonu skaits, bet atšķirīgs neitronu skaits, sauc par elementa izotopiem. Viena ķīmiskā elementa dažādo izotopu ķīmiskās īpašības praktiski neatšķiras, bet fizikālās īpašības var būt atšķirīgas.
Fakts, ka uz Zemes sastopami dažādi kāda ķīmiskā elementa izotopi, periodiskajā tabulā atspoguļojas tā, ka elementa relatīvā atommasa oglekļa vienībās u nav praktiski vesels skaitlis, kā tam būtu jābūt, ja visiem šā elementa atomiem kodolā būtu vienāds skaits neitronu. (skatīt tematu "vielas uzbūve"). Tā, piemēram, hēlija relatīvā atommasa ir nevis 4, bet 4,0026 (3. attēls).
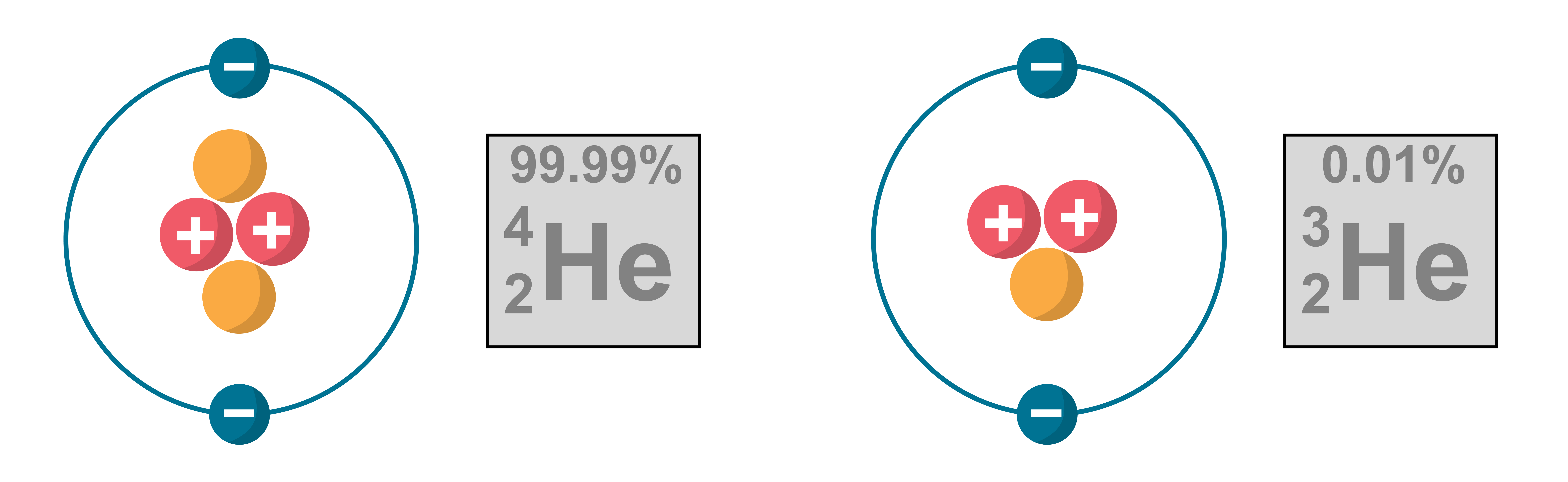
Daļa izotopu ir radioaktīvi, un radioaktīvās sabrukšanas rezultātā var pārvērsties citos elementos.
Ķīmiskās saites
Ķīmiskā saite ir ilgstoša atomu, jonu vai molekulu mijiedarbība, kas nodrošina ķīmisko savienojumu veidošanos un nosaka molekulas vai kristāla stabilitāti. Ķīmisko saiti nosaka mijiedarbība starp lādētām daļiņām (kodoliem un elektroniem). Ķīmiskās saites apraksta, pamatojoties uz kvantu mehāniku. Galvenās ķīmisko saišu īpašības ir stiprība, garums, polaritāte, stabilitāte.
Pastāv 6 veidu ķīmiskās saites:
- Metāliskā saite ir saite, kuras veidošanā piedalās brīvie elektroni (elektronu gāze), kas sadalīti pa visu metālisko elementu atomu un jonu veidoto kristālrežģi. Tā ir delokalizēta saite, kuru veido elektroni, kas pieder vairāk nekā diviem atomiem.
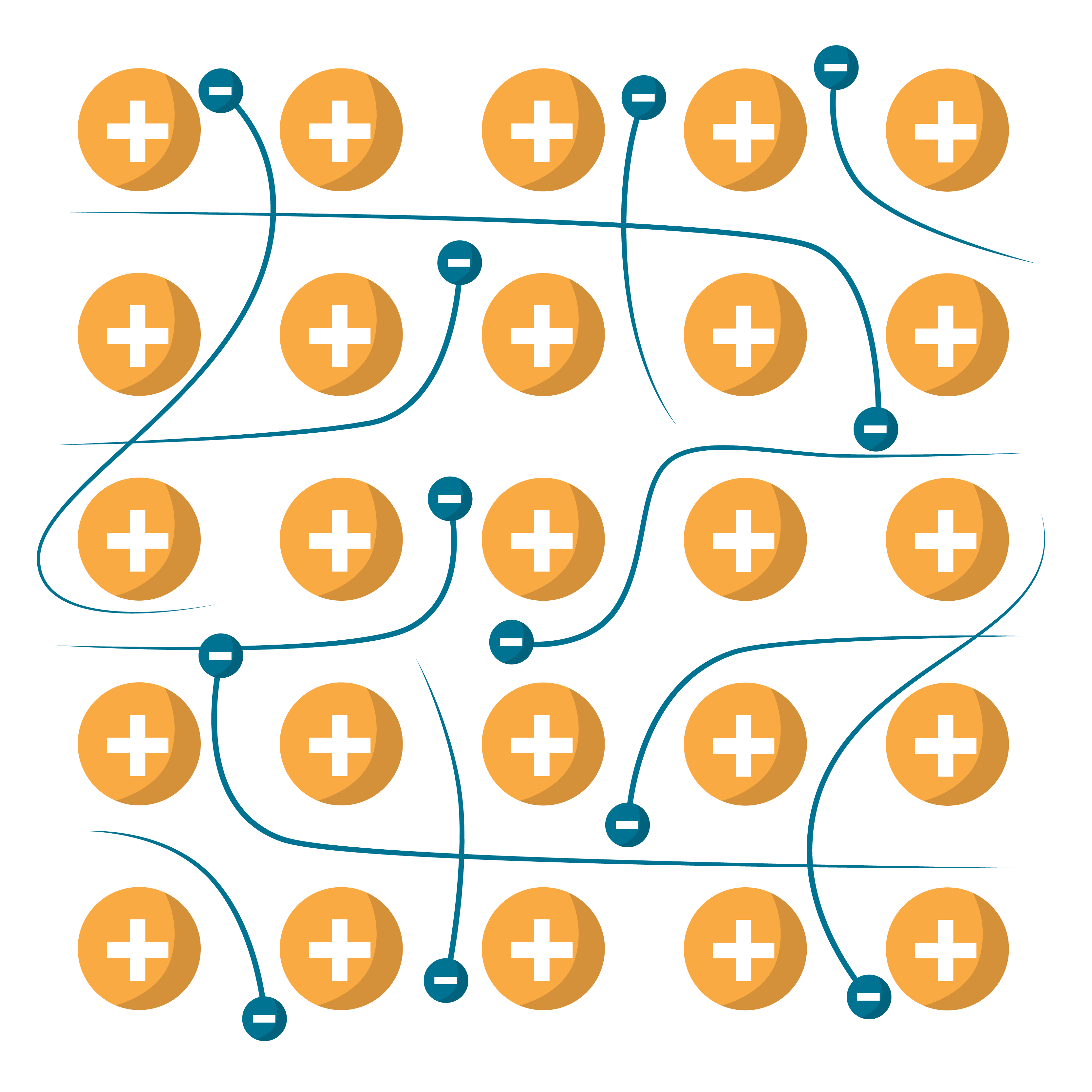
Metāliskā saite
- Jonu saite ir saite, kas pastāv, pateicoties savstarpējas pievilkšanās spēkam starp pozitīvi un negatīvi lādētiem joniem. Šāda saite pastāv savienojumos starp elementiem ar mazu elektronegativitāti (metāliem) un elementiem ar lielu elektronegativitāti (nemetāliem). Jonu saite pastāv, piemēram sāļos (NaCl), tipisko metālu oksīdos (K2O; BaO) in bāzēs (NaOH).
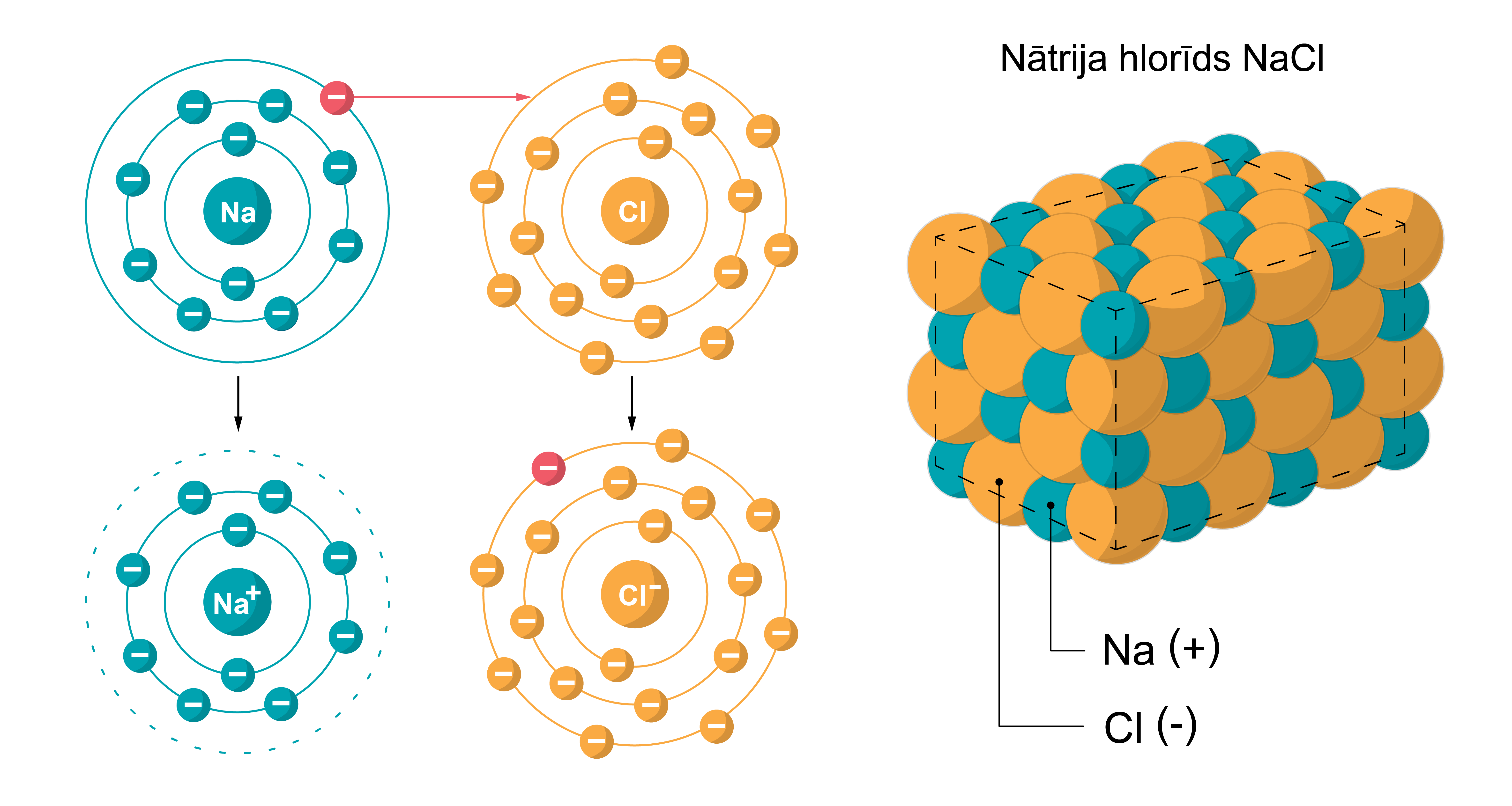
Jonu saite Kovalentā saite ir tāda ķīmiskā saite, kuru veido diviem atomiem kopīgs elektronu pāris. Izšķir 2 veidu kovalentās saites:
Nepolāra kovalentā saite, kas veidojas starp viena un tā paša ķīmiskā elementa atomiem (O, Cl, Br, I, H, N)
Nepolāra kovalentā saite Polāra kovalentā saite, kas veidojas starp elementu atomiem, kuru elektronegativitātes nav ļoti atšķirīgas, piemēram, H2O.
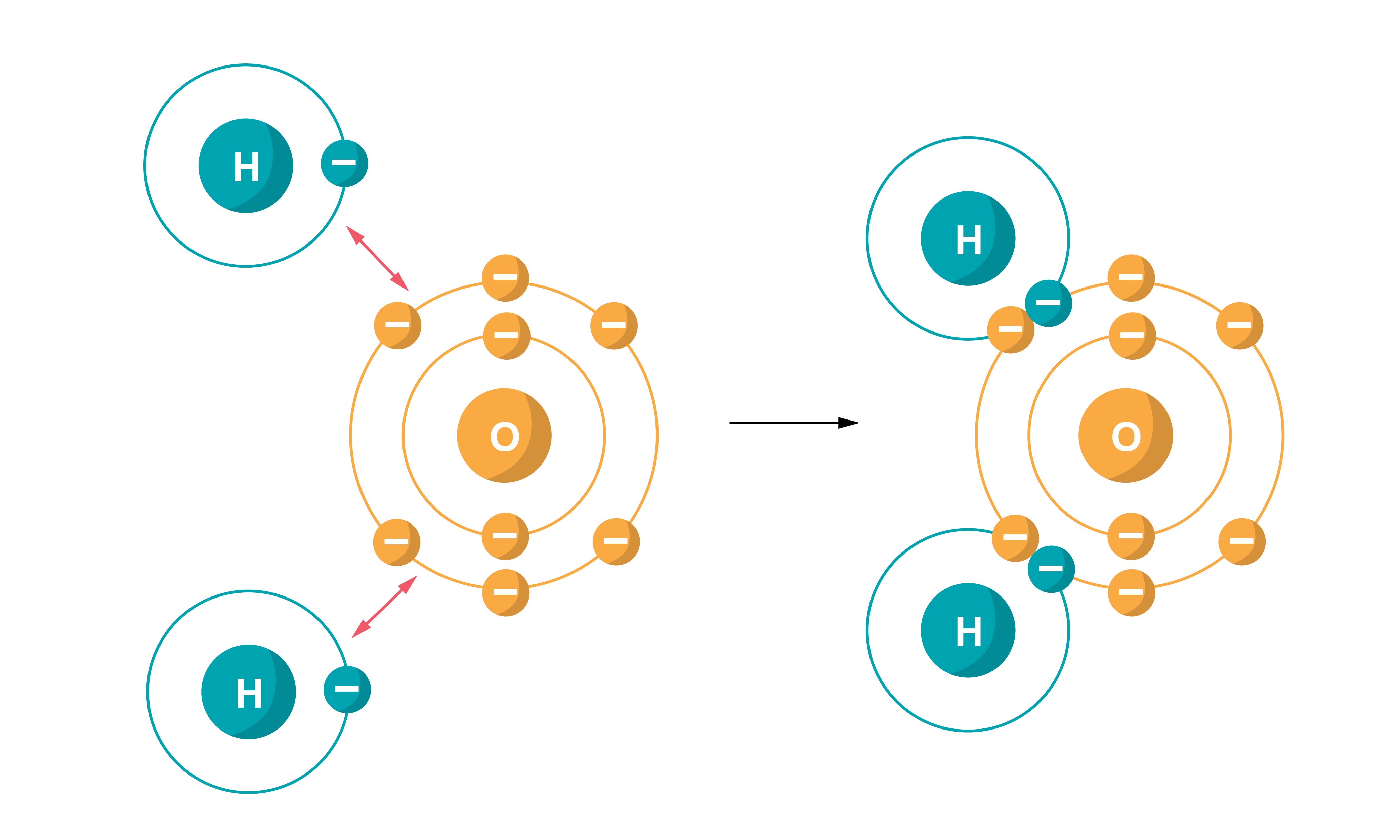
Polāra kovalentā saite Ūdeņraža saite ir saite, kas veidojas starp stipri elektronegatīva elementa atomu (F, O, N) un ūdeņraža atoma kodolu (protonu), kurš veido kovalento saiti ar citiem elektronegatīviem atomiem tajā pašā vai citā molekulā.
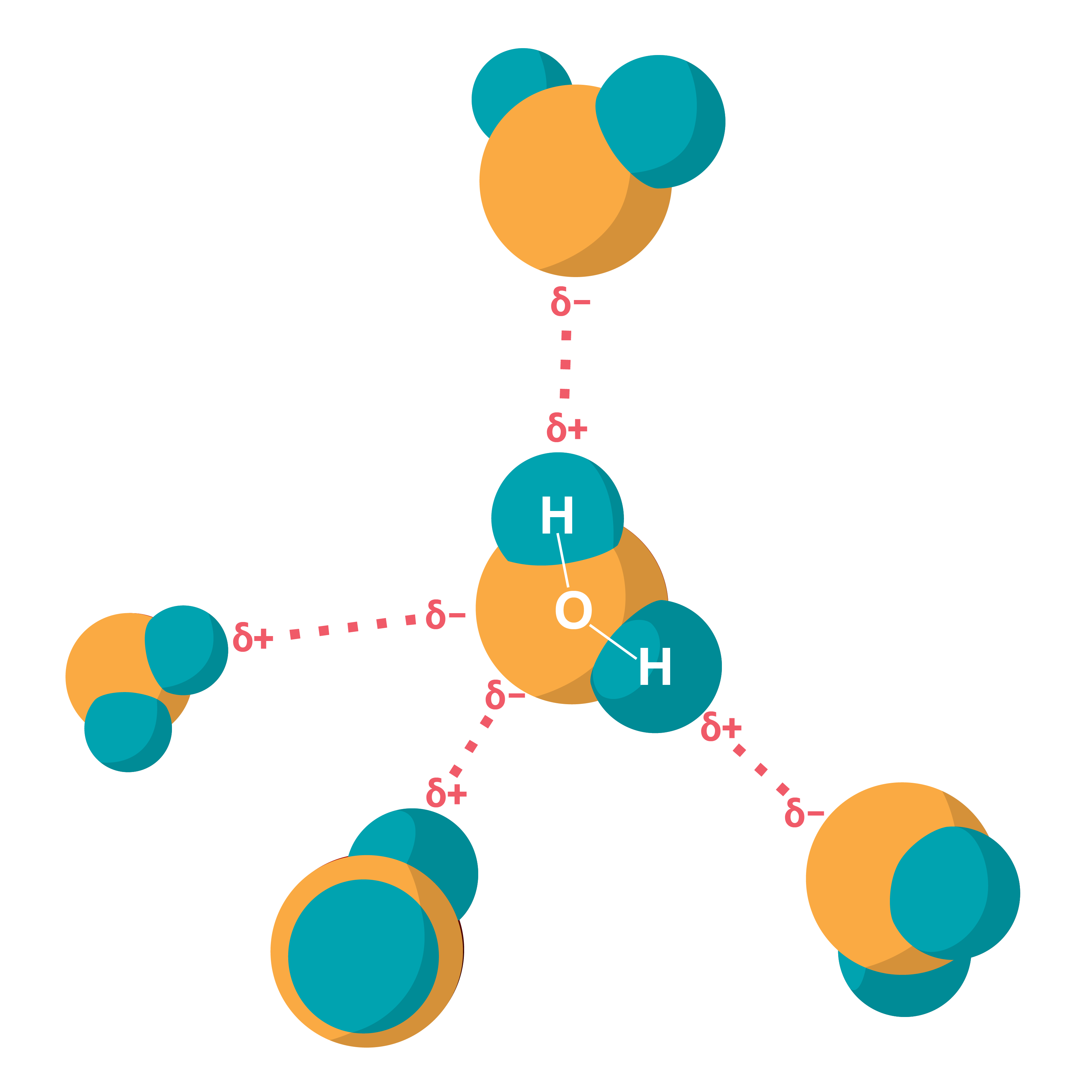
Ūdeņraža saite Van der Vālsa saite vai Van der Vālsa spēki ir starpmolekulāras (un starpatomu) mijiedarbības spēki. Mūsdienās šo terminu parasti piemēro spēkiem, kas rodas saistībā ar molekulu polarizāciju un dipolu veidošanos. Atklāja J. D. Van der Vāls 1869. gadā. Van der Vālsa spēki ietver mijiedarbību starp dipoliem (pastāvīgo un inducēto). Šīs mijiedarbības, kā arī ūdeņraža saites nosaka bioloģisko makromolekulu telpiskās struktūras veidošanos. Van der Vālsa spēki nosaka arī inerto gāzu (gāzes, šķidruma un cietvielu) agregātstāvokļu pastāvēšanas iespēju.
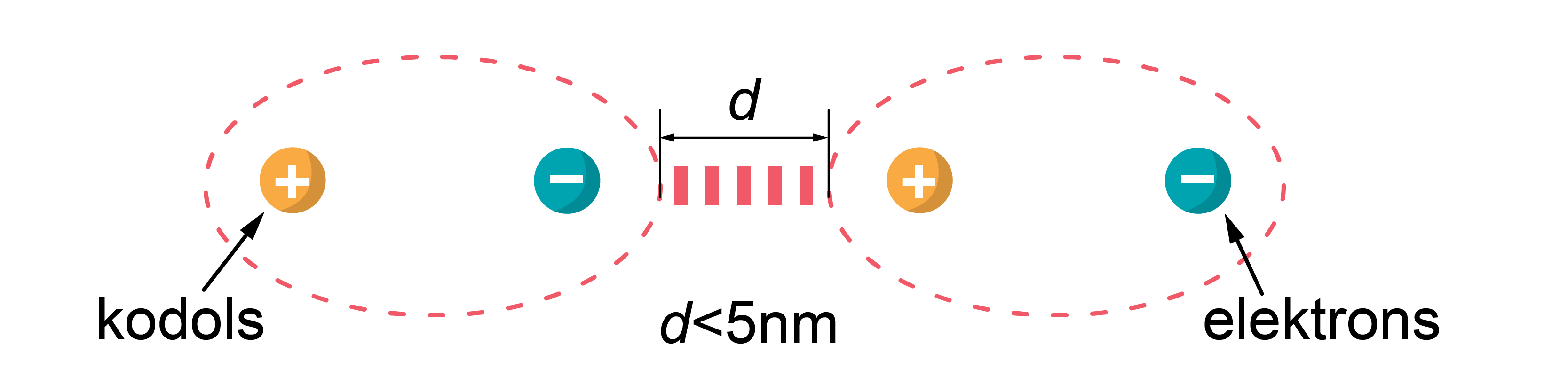
Van der Vālsa saite