Ikdienā ir pierasts iedalīt vielas trīs agregātstāvokļos: cietā, šķidrā un gāzveida. Atkarībā no spiediena un temperatūras viela atrodas kādā no agregātstāvokļiem, bet, mainoties fizikālajiem apstākļiem, var notikt pāreja no viena agregātstāvokļa uz citu (1. att.). Jau ierastais ūdens normālā atmosfēras spiedienā temperatūrā zem 0o C atrodas cietā agregātstāvoklī (ledus). Ja temperatūra pieaug un sasniedz 0o C, tad ledus sāk kust un pārvēršas šķidrā agregātstāvoklī (šķidrs ūdens). Ja temperatūra turpina pieaugt un sasniedz vārīšanās temperatūru 100o C, tad šķidrais ūdens sāk pastiprināti iztvaikot un ieņemt gāzveida stāvokli (ūdens tvaiks). Ja temperatūru pēc tam samazina, tad ir novērojami pretēji procesi. Vispirms ūdens tvaiks pārvēršas šķidrā ūdenī jeb kondensējas, bet, kad sasniedz 0o C, tad šķidrais ūdens sacietē un pārvēršas par ledu.
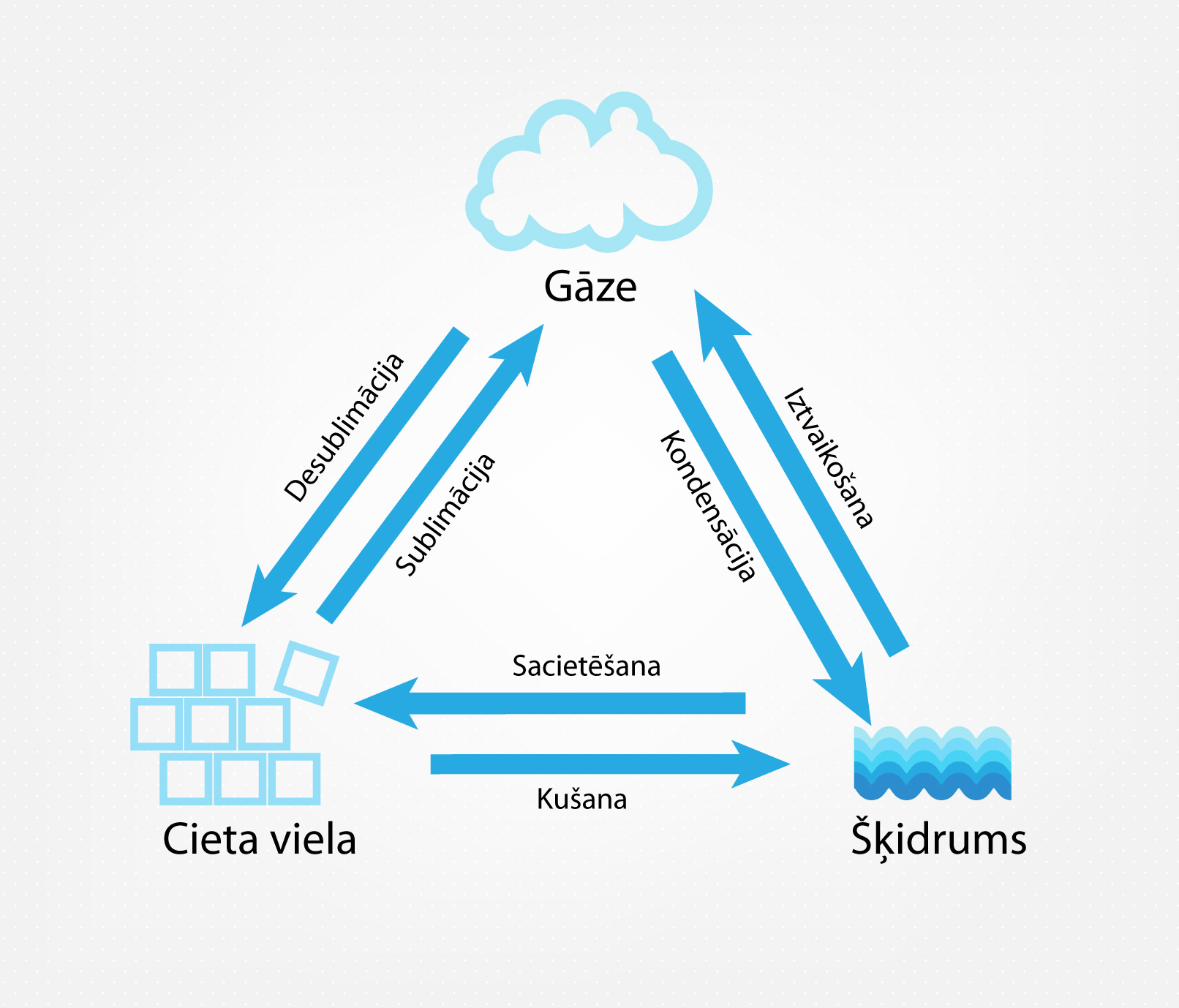
1.att. Vielas stāvokļu savstarpējā maiņa
Pastāv iespēja, ka viela no cieta stāvokļa uzreiz pāriet gāzveida stāvoklī un otrādi, neizejot cauri šķidrajam agregātstāvoklim. Sublimācija ir process, kad viela no cieta stāvokļa uzreiz pāriet gāzveida stāvoklī. Ja mēģināsi sala laikā žāvēt veļu (2. att. a), tad tas tīri labi arī sanāks, jo veļā esošais ūdens sasalst un sublimācijas procesa iespaidā pamazām iztvaiko, līdz veļa kļūst sausa. Sublimāciju var ļoti labi novērot, ja normālos apstākļos novieto sauso ledu jeb sasalušu ogļskābo gāzi (2. att. b). Sublimācijai pretējo procesu sauc par desublimāciju, kad viela no gāzveida stāvokļa uzreiz pāriet cietā stāvoklī. Desublimāciju var novērot ziemā, kad uz automašīnas stikliem veidojas ledus kārtiņa. Mikroelektronikas rūpniecībā šo procesu izmanto, lai iegūtu plānas kristāliskas kārtiņas.

2.att. Sublimācijas piemēri
Jau sadaļā par siltuma daudzumu tika apskatīts, kā viela no viena agregātstāvokļa pāriet citā jeb piedzīvo ekstrēmas pārvērtības (3. att.).
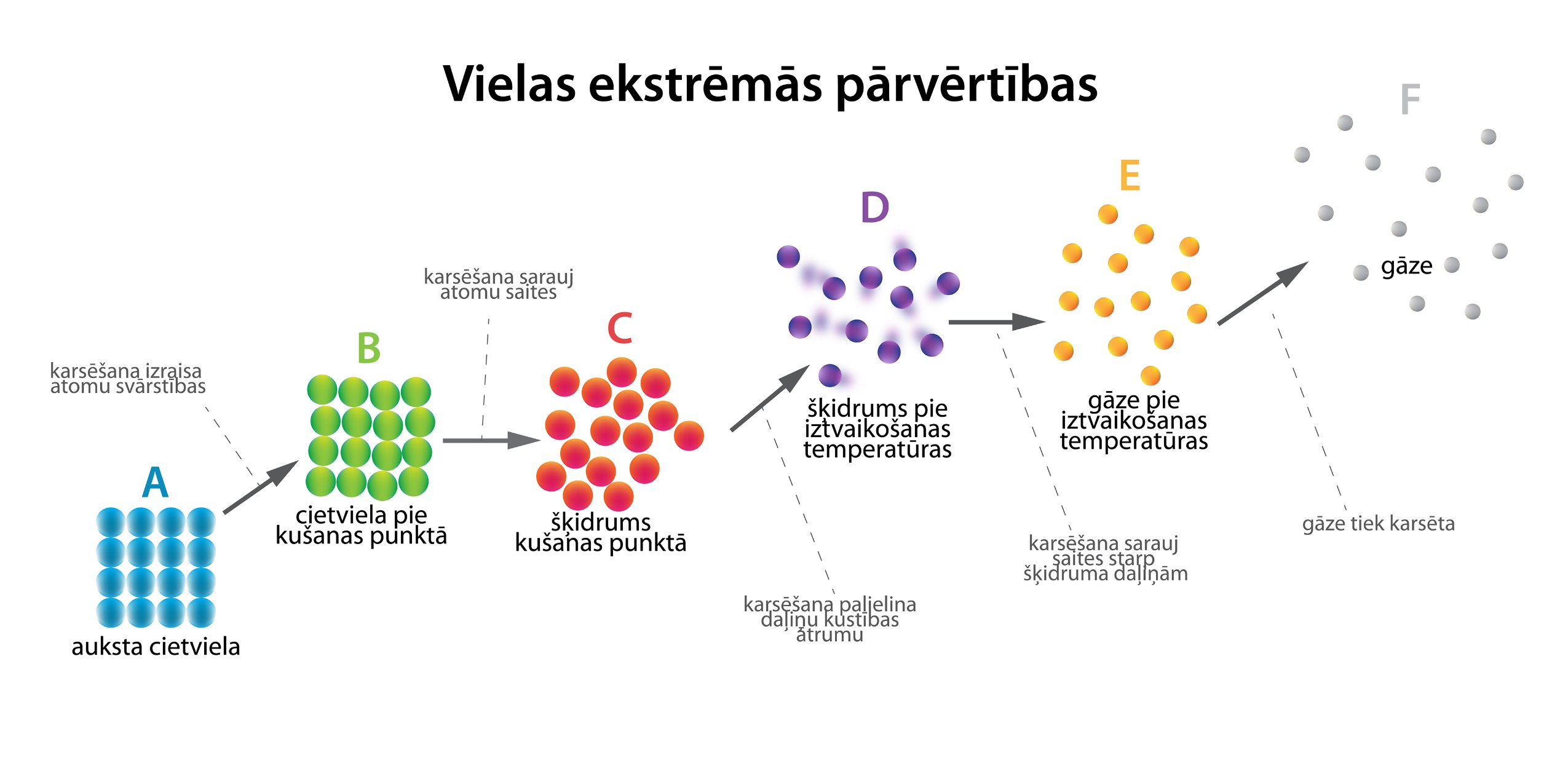
3.att. Vielas ekstrēmās pārvērtības
Tika apskatīts arī grafiks temperatūras atkarībai no siltuma pievadīšanas ilguma (4. att.). Grafikā uzskatāmi parādās divi laika momenti, kuros temperatūras nemainās. Tie atbilst kušanas (B–C) un iztvaikošanas (D–E) procesiem, kurus raksturo energoietilpīga saišu starp vielas daļiņām saraušana. Slīpie grafika posmi atbilst vielas sildīšanai dažādos agregātstāvokļos.
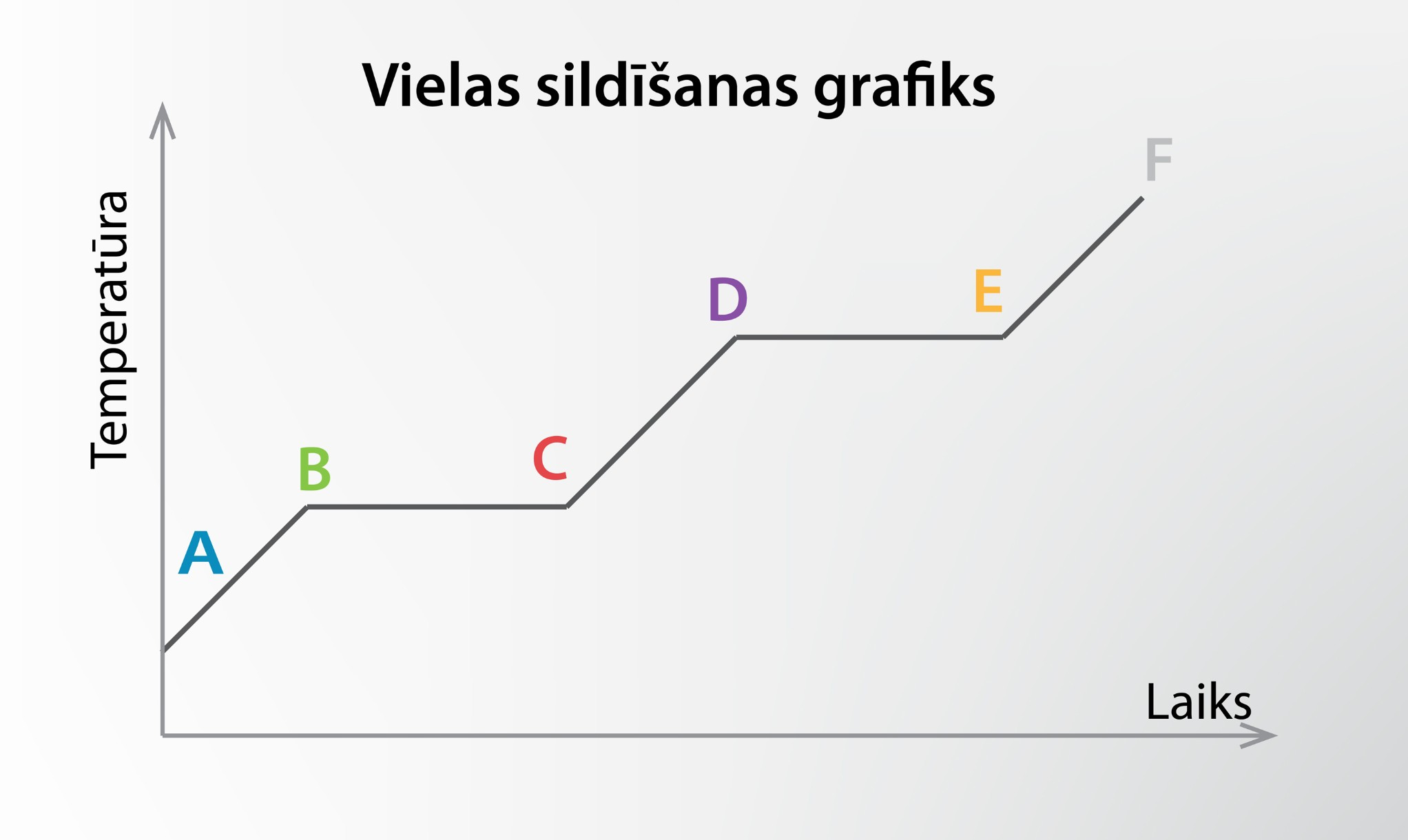
4.att. Vielas sildīšanas/dzesēšanas grafiks
Ja tiek sildīts vai dzesēts ļoti tīrs šķidrums, tad temperatūras atkarības grafiks var izskatīties nedaudz citādāk, nekā redzams 4. attēlā. Ja šķidrums ir atdzesēts līdz sacietēšanas temperatūrai, tad, lai sāktos sacietēšana, šķidrumā ir nepieciešami kristalizācijas centri, par kuriem parasti kalpo “piemaisījumi”, kas atrodami šķidrumā. Ja šķidrums ir ļoti tīrs, tad var novērot situāciju, ka temperatūra noslīd zem sacietēšanas temperatūras Ts, bet šķidrums vēl nesāk sacietēt (5. att. a). Pēc kāda brīža sacietēšana tomēr sākas un temperatūra paaugstinās līdz Ts. Līdzīgs efekts var notikt, ja tīru šķidrumu uzkarsē līdz vārīšanās temperatūrai TV. Lai šķidrums sāktu vārīties, tajā ir nepieciešami vārīšanas centri, līdz ar to ļoti tīru ūdeni ir iespējams uzsildīt virs TV tā, kas tas vēl nesāk vārīties (5. att. b). Šādu šķidrumu sauc par pārkarsētu. Pārkarsētu šķidrumus izmanto tā saucamajās burbuļkamerās, ar kuru palīdzību novēro elektriski lādētu daļiņu trajektorijas.
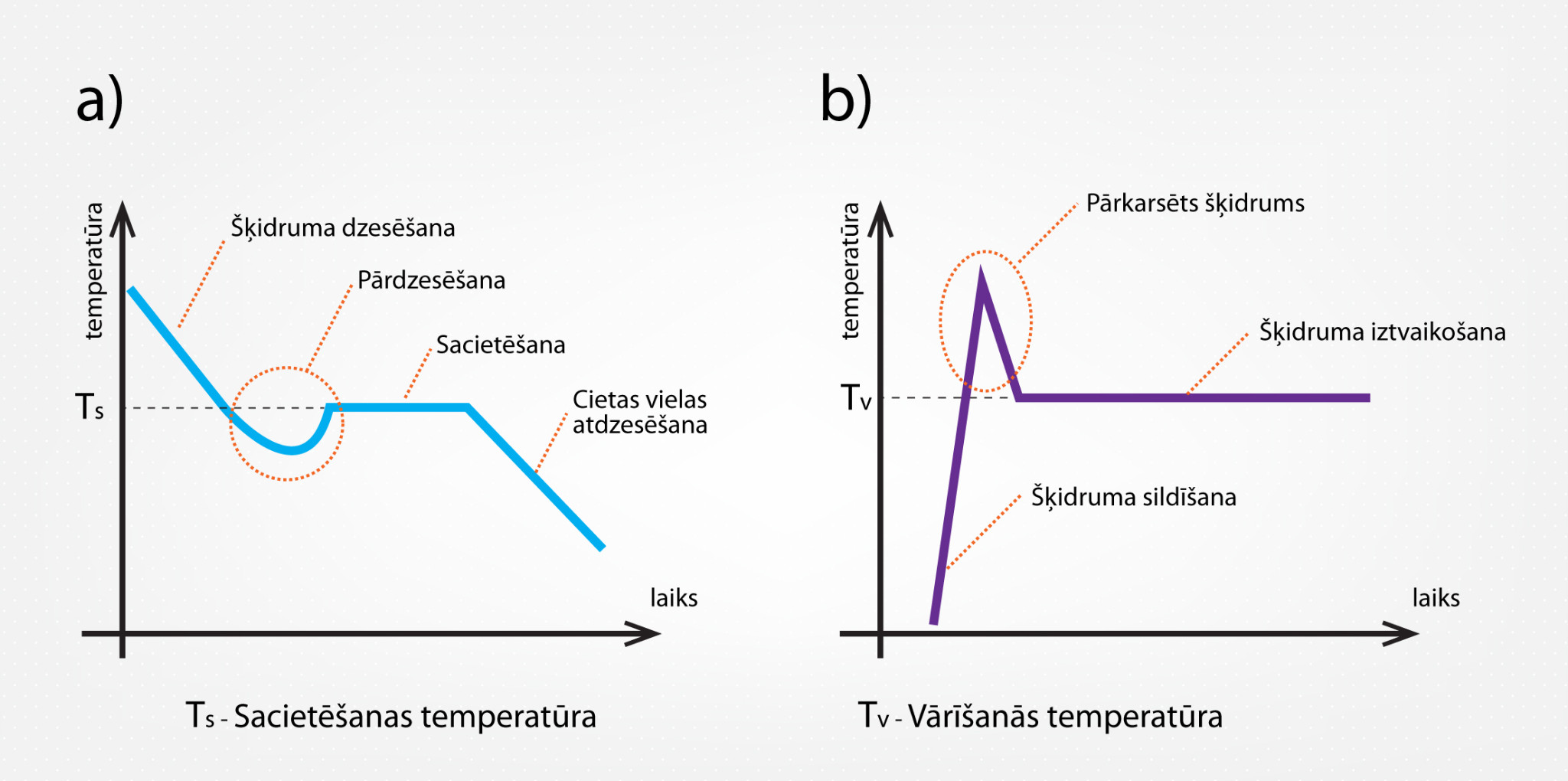
5.att. Šķidruma pārdzesēšana (a) un pārkarsēšana (b)
Blakus trīs apskatītajiem agregātstāvokļiem aplūko arī ceturto – plazmu. Plazma ir jonizēta gāze, kas veidojas, piemēram, sakarsējot gāzes līdz augstām temperatūrām (6. att.). Atšķirībā no gāzes plazma ir elektrovadītājs. Plazmu izmanto, piemēram, plazmas gaismas avotos un plazmas televizoros.

6.att. Dekoratīvā plazmas lampa
Termodinamikā aplūko sistēmas, kas ir gan homogēnas, gan nehomogēnas. Homogēnās jeb viendabīgās sistēmās īpašības un struktūra visā sistēmā ir viena un tā pati. Savukārt nehomogēna sistēma sastāv no vairākiem apgabaliem, kuriem atšķiras gan īpašības, gan struktūra un kurus citu no cita atdala robežvirsma. Šos apgabalus sauc par fāzēm. Dažādas fāzes atdala robežvirsma. Ja apskata aizskrūvētu limonādes pudeli (1. att.), tad tajā ir redzamas divas fāzes:
1) limonāde,
2) virs limonādes esošais gāzu un ūdens tvaika maisījums.
Šīs fāzes uzskatāmi atdala robežvirsma.

1.att. Aizskrūvēta limonādes pudele
Aplūkojot iepriekšējo piemēru, var secināt, ka dažādiem agregātstāvokļiem atbilst dažādas fāzes, tomēr fāzes jēdziens ir daudz plašāks. Ja aplūko cietu oglekli (2. att.), tad tam ir iespējamas vismaz četras dažādas fāzes (2. att.):
1) grafīts,
2) oglekļa nanocaurulīte,
3) fulerēns,
4) dimants.
Šajās atšķirīgajās fāzēs oglekļa atomiem ir dažāds izkārtojums, un katrai no šīm fāzēm ir stipri atšķirīgas fizikālās īpašības. No šī piemēra var secināt, ka agregātstāvokļa maiņa vienmēr nozīmē fāzes maiņu, bet fāzes maiņa ne vienmēr nozīmē agregātstāvokļa maiņu, jo visas četras oglekļa fāzes atbilst cietas vielas agregātstāvoklim.
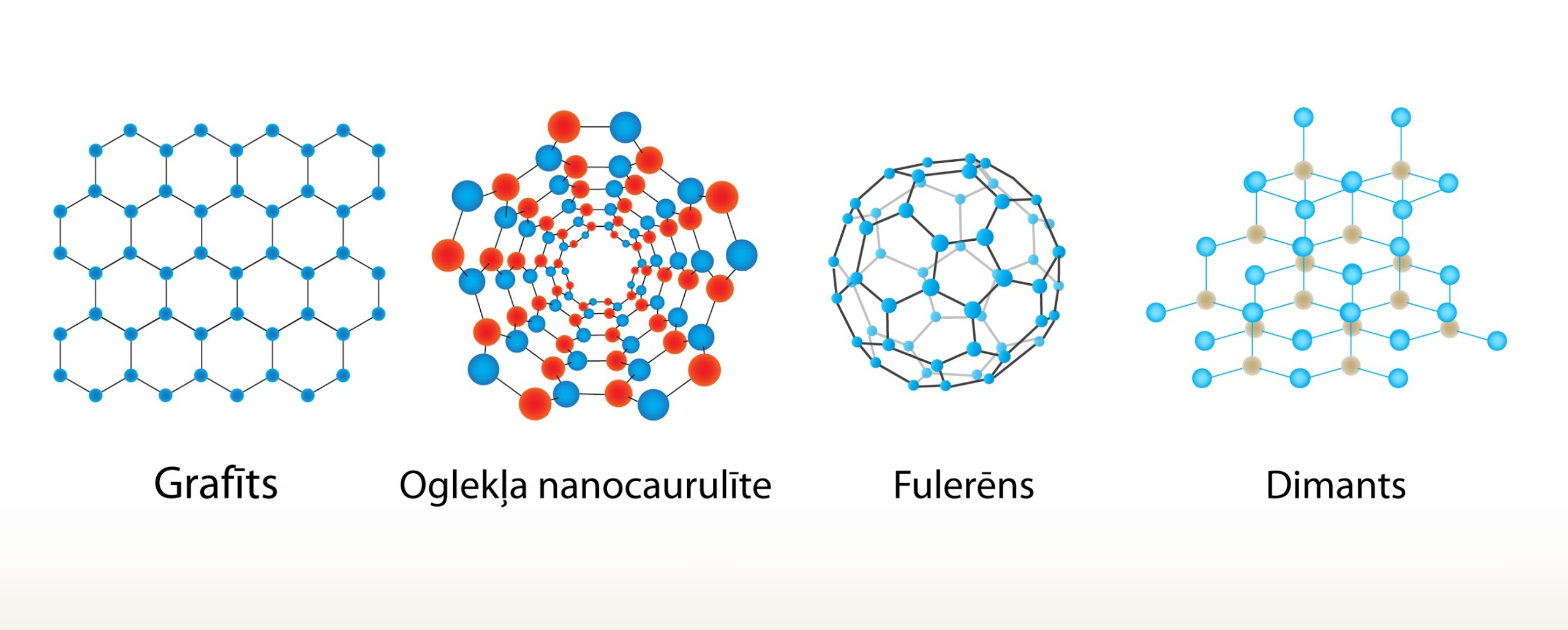
2.att. Dažādas cieta oglekļa fāzes
Ja istabas temperatūrā apskatu sistēmu, kurā ūdenī peld ledus kubiņš, tad šeit var novērot dažādas ūdens fāzes un to robežvirsmas. Ar robežvirsmu ir atdalīta gan ūdens cietā un šķidrā fāze, gan šķidrā un gāzveida fāze, kā arī cietā un gāzveida fāze. Tomēr šāda sistēma istabas temperatūrā un normālā atmosfēras spiedienā ir nestabila, jo pēc kāda laika ledus gabaliņš izkūst un cietā ūdens fāze pazūd.
Izmēģini simulāciju, kur vari paspēlēties ar agregātstāvokļiem un fāzēm!

3.att. Ūdenī peldošs ledus kubiņš
Tomēr vielām pastāv tādi fizikālie apstākļi (spiediens un temperatūra), kad iestājas līdzsvars starp dažādām fāzēm. Šos fizikālos apstākļus raksturo vielas stāvokļa diagramma (4. att.). Šajā diagrammā līnijas norāda to spiediena un temperatūras kombināciju, kurā starp dažām vielas fāzēm iestājas dinamisks līdzsvars. 4. attēlā redzams, ka vielas stāvokļa diagrammā ir punkts, kurā krustojas visas līnijas. To sauc par trīskāršo punktu, un tajās visas trīs fāzes (ciets, šķidrs, gāzveida) pastāv dinamiskā līdzsvarā.
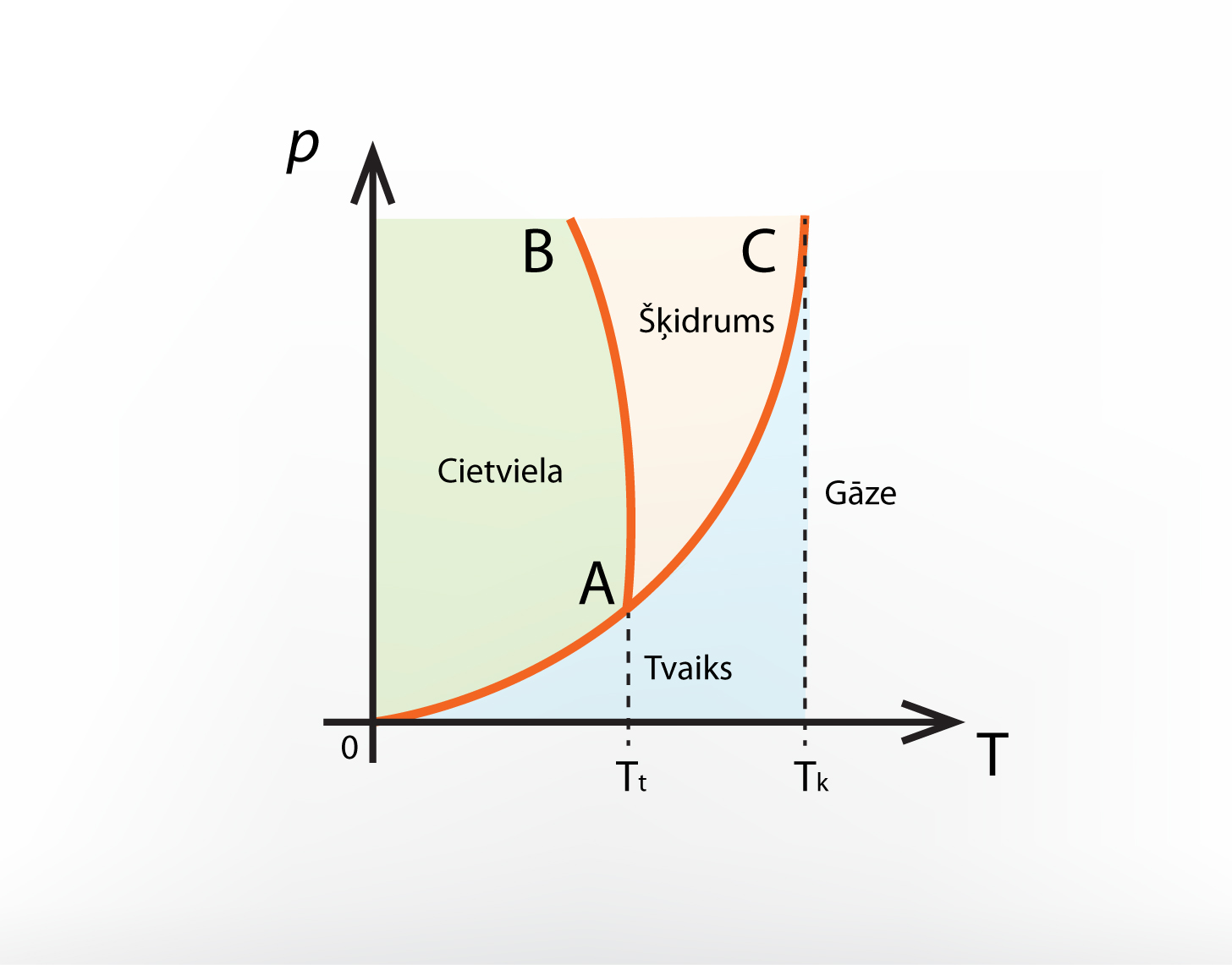
4.att. Vielas stāvokļa diagramma
Ūdens trīskāršais punkts atrodas pie spiediena p = 610 Pa un temperatūras T = 273,16 K (5. att.). Interesanti, ka ūdens trīskāršā punkta temperatūra ir tikai par 0,01 K grādu augstāka nekā ūdens kušanas temperatūra normālā spiedienā.
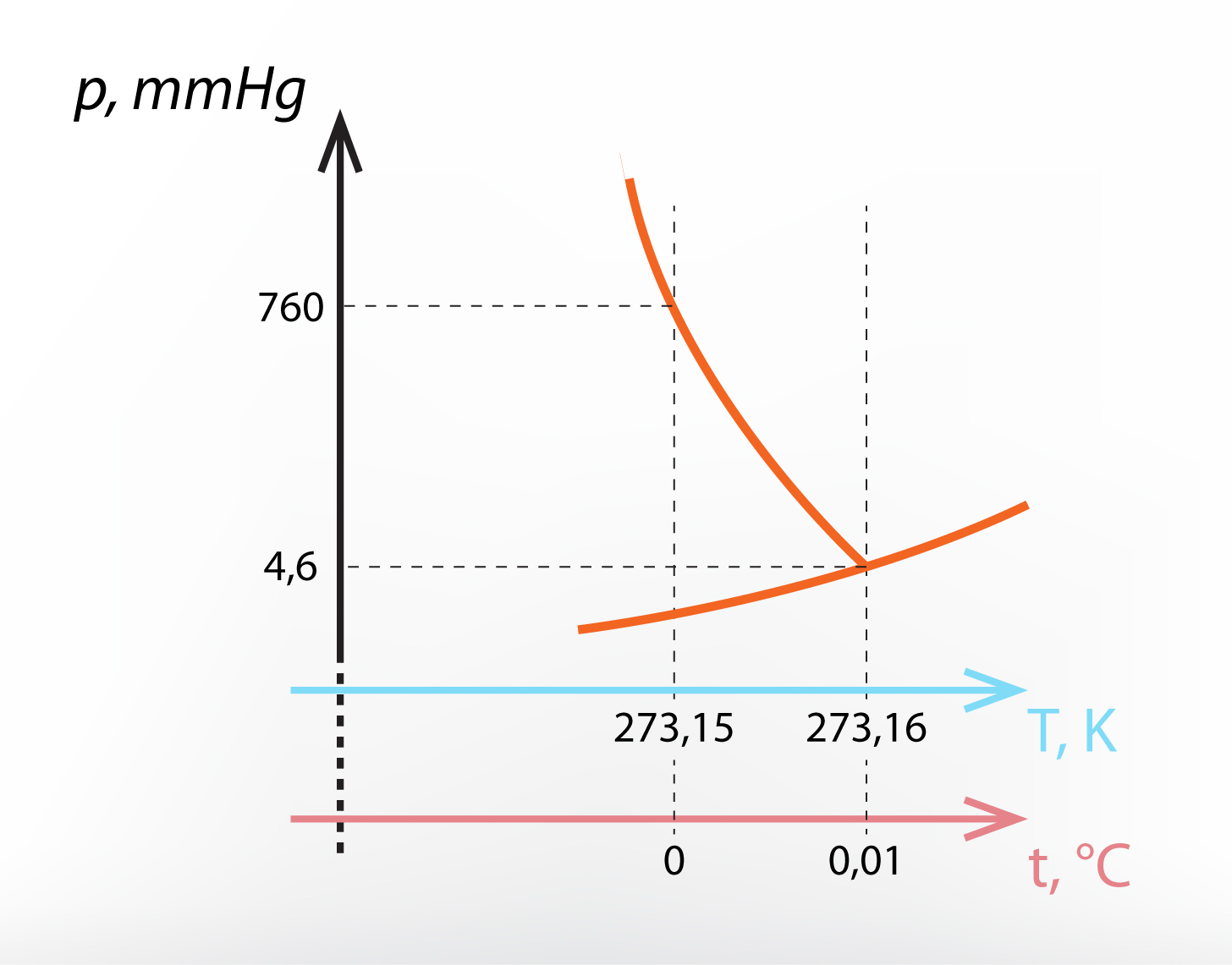
5.att. Ūdens fāžu diagramma trīskāršā punkta apkārtnē
Dažādām vielām trīskāršais punkts atšķiras. Šīs atšķirības uzskatāmi parāda 6. attēls.
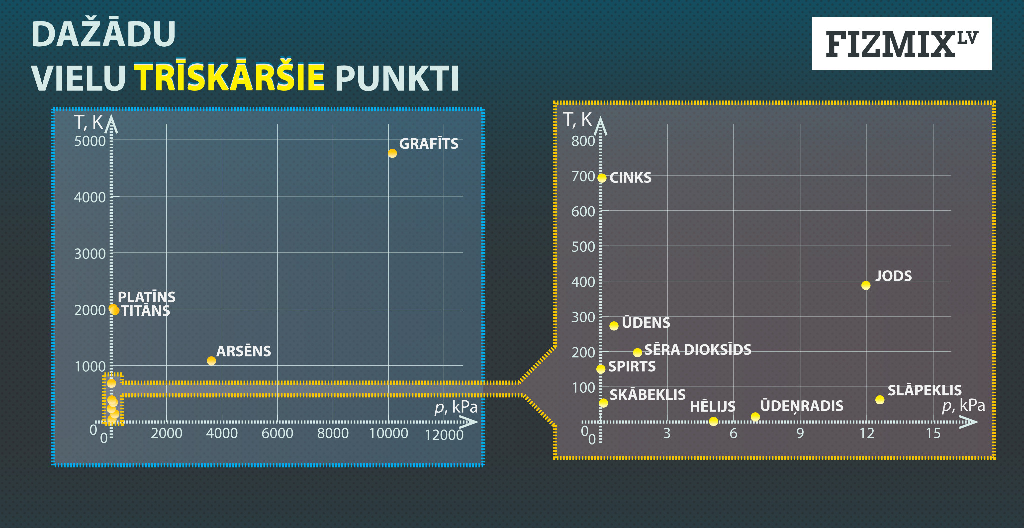
5.att. Trīskāršo punktu info grafiks
Ja šķidrumu silda noslēgtā traukā (1. att.), tad, paaugstinoties temperatūrai, šķidruma blīvums samazinās (izplešanās dēļ). Savukārt virs šķidruma esošā piesātināta tvaika blīvums palielinās, jo tvaikā nonāk arvien jaunas molekulas. Ja šīs šķidruma un tvaika blīvuma izmaiņas atkarībā no temperatūras attēlo grafikā, tad var redzēt, ka ir punkts, kurā abas blīvuma līknes krustojas (1. att.). Šo punktu sauc par kritisko punktu, bet temperatūru, pie kuras šis stāvoklis iestājas – par kritisko temperatūru. Kritiskajā stāvoklī izzūd atšķirība starp tvaiku un šķidrumu.
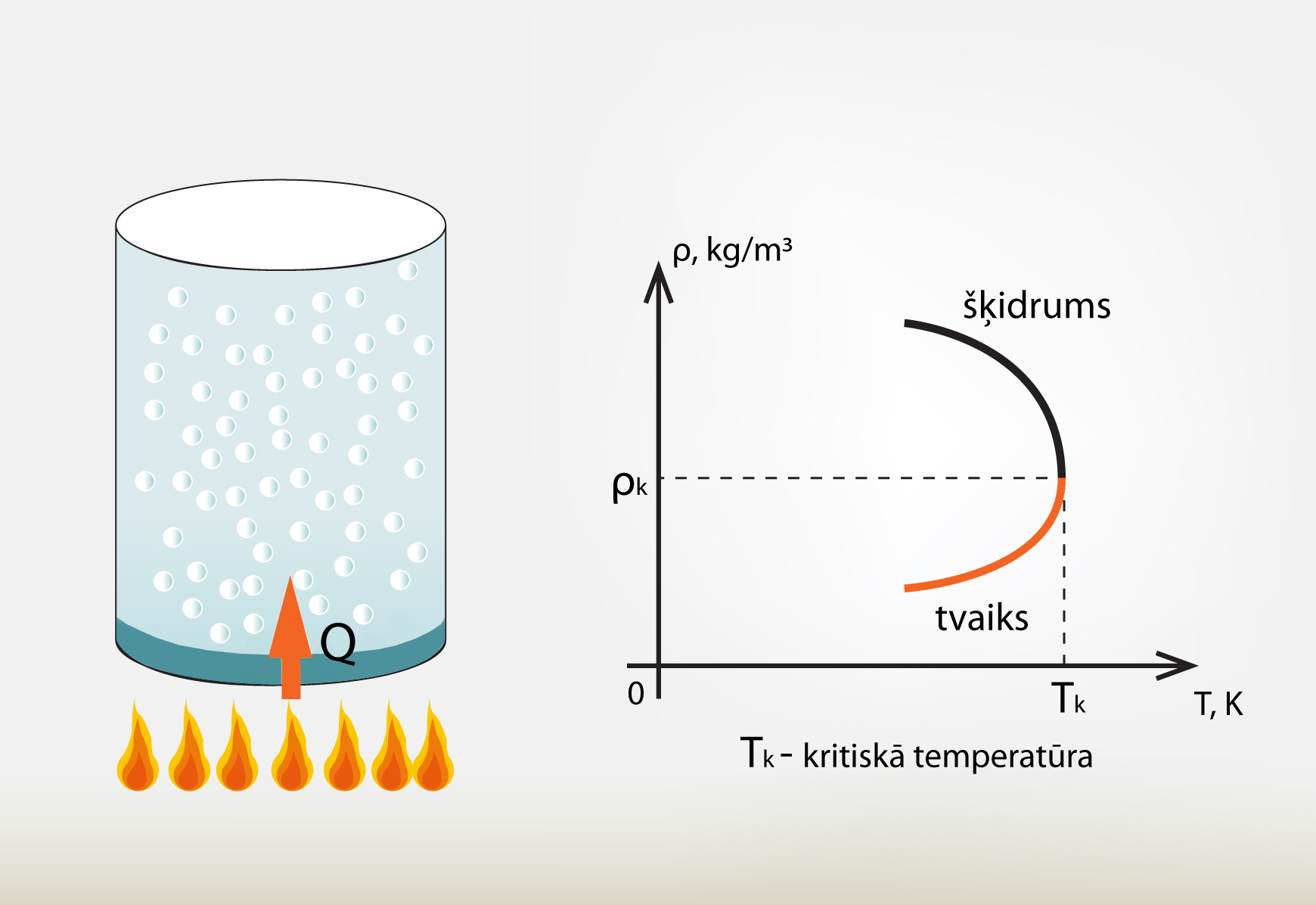
1.att. Kritiskais punkts un kritiskā temperatūra
Sasniedzot kritisko temperatūru, šķidruma virsmas spraiguma koeficients kļūst vienāds ar nulli, jo izgaist robežvirsma starp šķidrumu un tvaiku. Ūdens kritiskā temperatūra ir 374 oC, bet piesātināta tvaika blīvums 300 kg/m3 (2. att. a). Tas nozīmē: ja noslēgtā traukā būtu ūdens un to uzsildītu virs 374 oC, tad šajā traukā vairs nepastāvētu šķidrs ūdens (2. att. b).
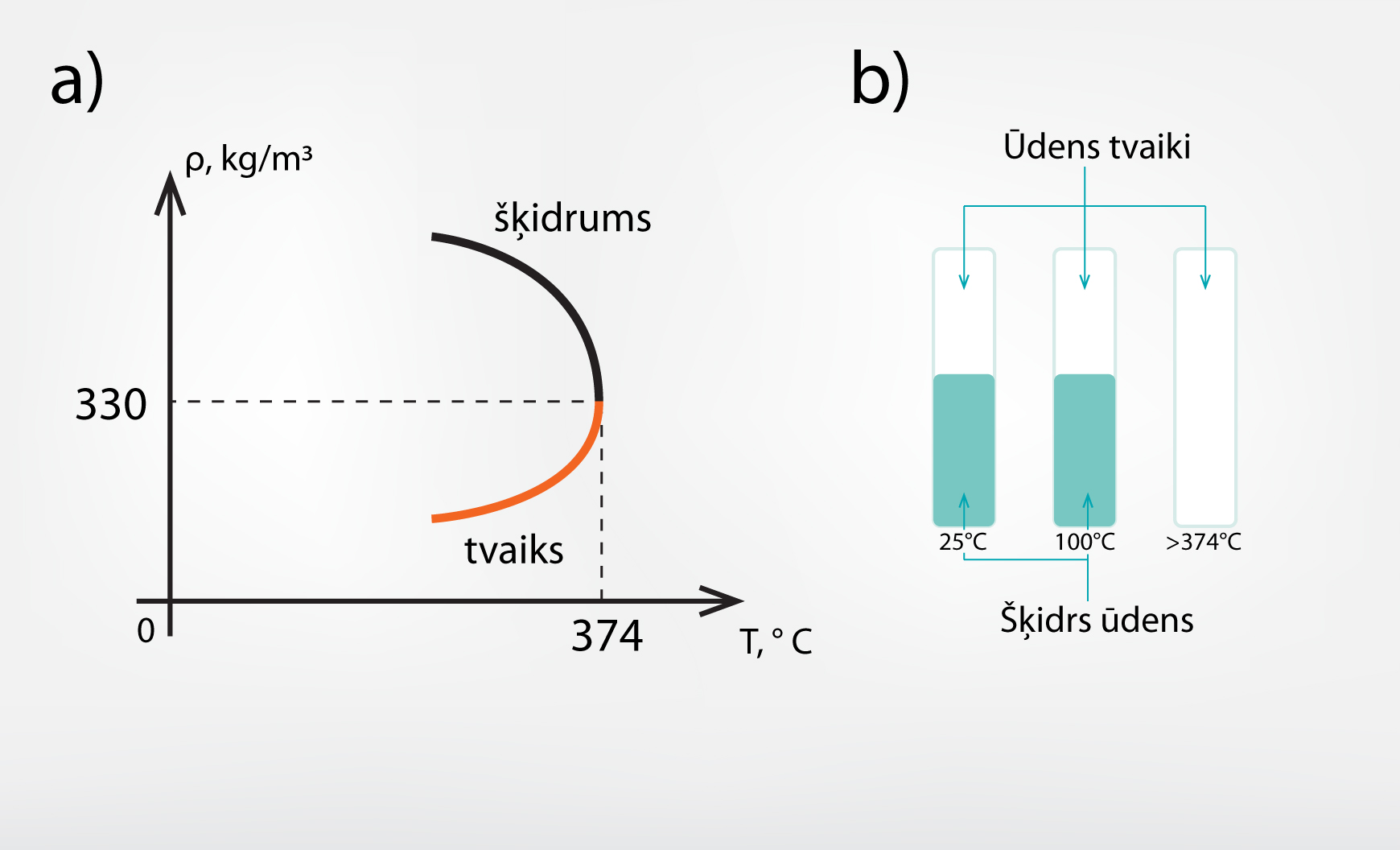
2.att. Ūdens kritiskais punkts un kritiskā temperatūra
Ja vielas temperatūra pārsniedz kritisko temperatūru, tad viela atrodas gāzveida stāvoklī un to nekādi nevar pārvērst šķidrumā, lai arī kādu spiedienu izmantotu. Tas ir iemesls, kādēļ mēs normālos dabā sastopamos fizikālos apstākļos sakām, ka gaiss satur, piemēram, skābekļa un slāpekļa gāzi, nevis tvaikus. Skābekļa kritiskā temperatūra ir -118 oC, bet slāpeklim tā ir -146 oC. Tas nozīmē, ka dabā sastopamajās temperatūrās šīs vielas var pastāvēt tikai gāzveida fāzē. Turpretī, atšķirībā no nosauktajiem piemēriem, ūdens kritiskā temperatūra ir 374 oC, tādēļ gaiss satur ūdens tvaikus, nevis gāzi. Dažādu vielu kritiskās temperatūras var apskatīt 3. attēlā.
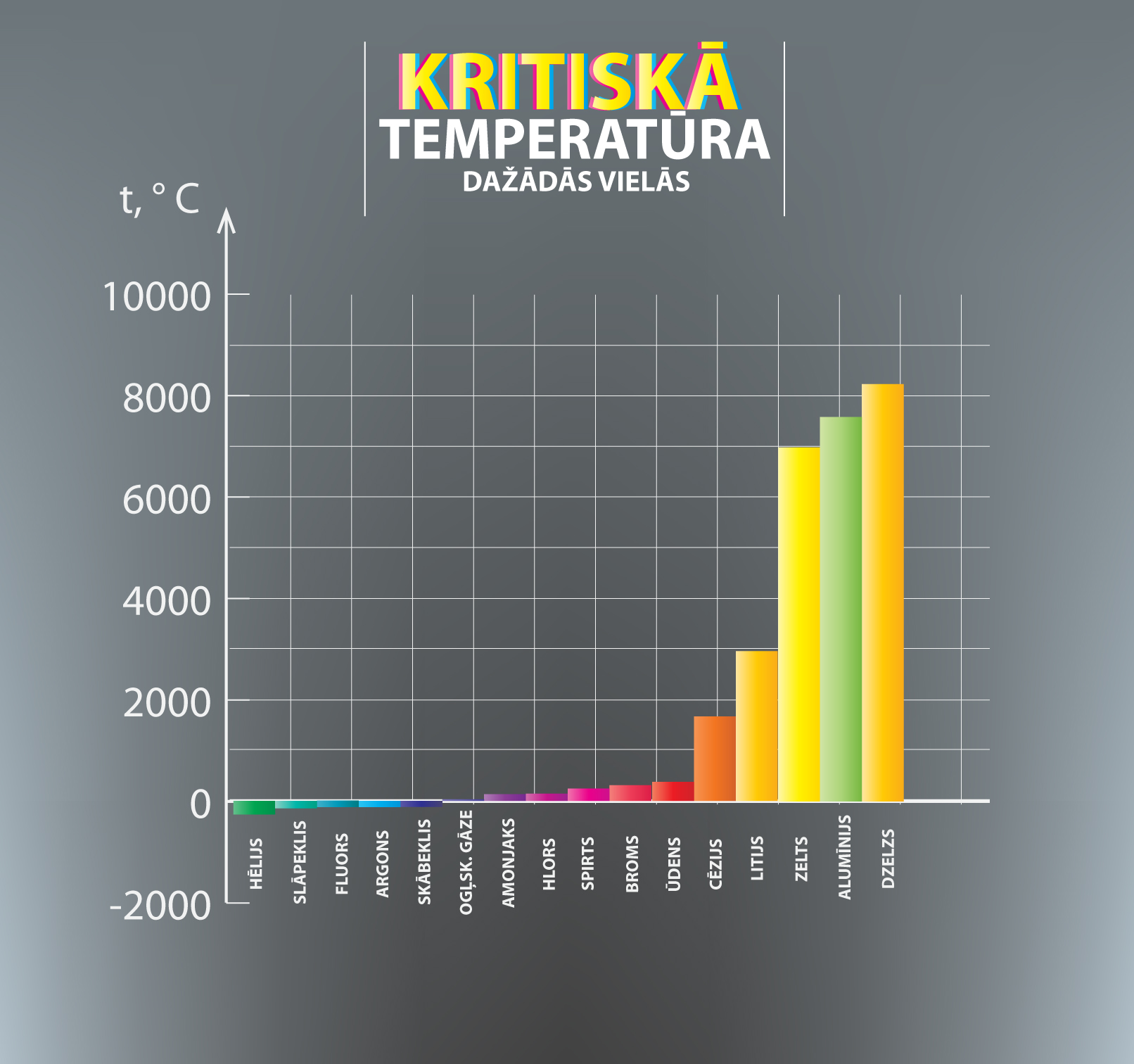
3.att. Kritisko temperatūru info grafiks
Iepriekš tika apskatītas fāžu pārejas, kas atbilda dažādu agregātstāvokļu maiņām, kā arī viena veida atomu spēja sakārtoties dažādos veidos un veidot dažādas vielas fāzes. Visas šīs dažādās fāzes var ārēji atšķirt, jo katrai no tām piemīt fizikālās īpašības, kas ir ar aci pamanāmas. Tomēr pastāv arī fāžu pārejas, kurās ārēji pamanāmas izmaiņas vielā nenotiek. Tāda, piemēram, ir fāžu pāreja uz supravadošu stāvokli (stāvokli, kurā vielai nav elektriskās pretestības). Ja vielas dzesē, tad to elektriskā pretestība parasti vienmērīgi samazinās. Tomēr pastāv vielas, kurām pie noteiktas temperatūras TSpretestība pēkšņi samazinās līdz nullei (4. att.). Tādā gadījumā ir notikusi fāžu pāreja uz supravadošu stāvokli bez ārējām pamanāmām izpausmēm.
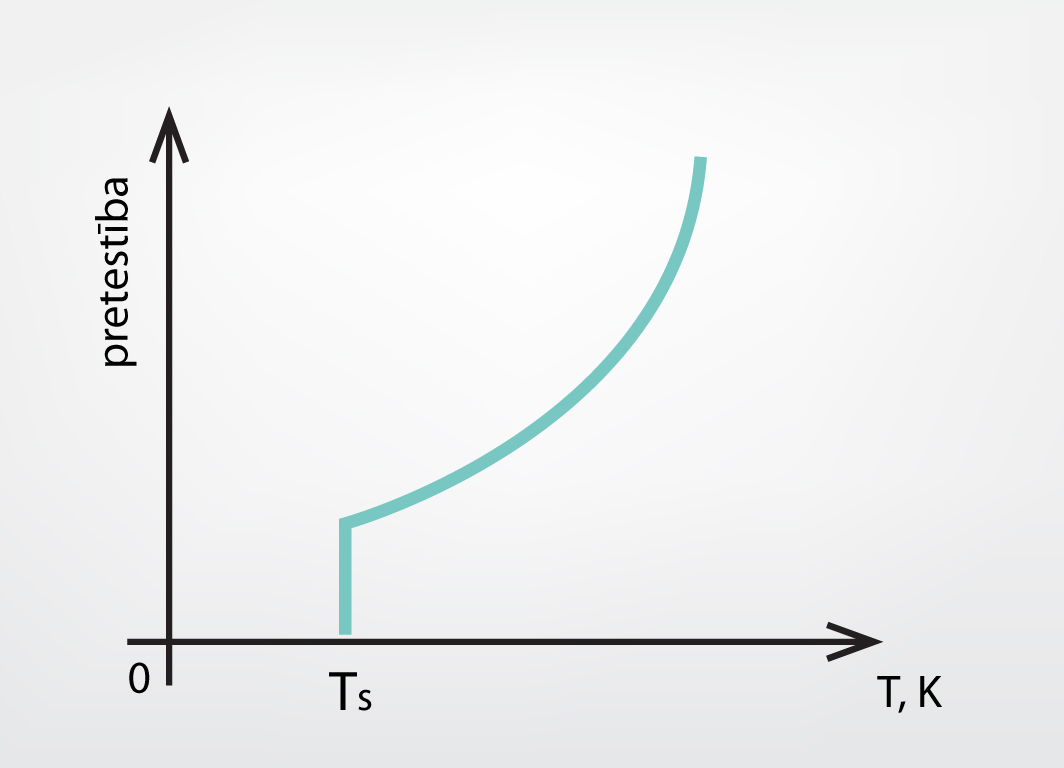
4.att. Supravadītspējas iestāšanās
Sadaļas par siltuma daudzumu 3. solī tika noskaidrots, ka gāzi raksturo divas siltumietilpības. Viena ir siltumietilpība izobāriskā procesā Cp, bet otra ir siltumietilpība izohoriskā procesā CV. Pastāv vielas, kurām pie noteiktas temperatūras TC notiek „lēciens” CV siltumietilpības vērtībā (5. att.). Arī šajā gadījumā notiek fāžu pāreja bez ārēji redzamām izpausmēm.
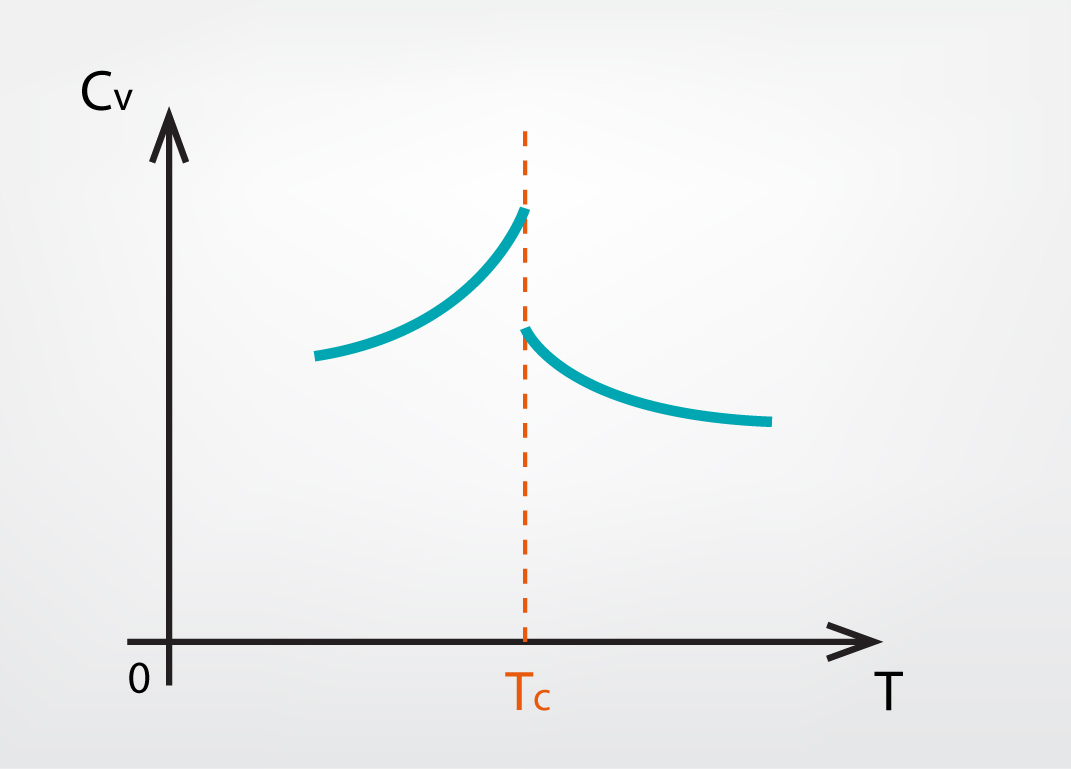
5.att. Izohoriskās siltumietilpības maiņa atkarībā no temperatūras
Skaties video, kā tiek sasalst pārdzesēts ūdens!
Skaties iespaidīgu skatu video par pārkarsētu šķidrumu:
Magnēta levitācija virs supravadoša materiāla: