Šķidrumā molekulas atrodas cieši cita pie citas un savstarpēji mijiedarbojas, noturot cita citu šķidrumā un neļaujot aizlidot prom. Tomēr, kā noskaidrojām sadaļā par šķidrumu īpašībām, šķidruma virsmas tuvumā esošās molekulas ir pakļautas īpašiem apstākļiem, jo tās kaimiņu molekulas ieskauj tikai no vienas puses, tādēļ tām ir jāpārvar mazāks mijiedarbības spēks, lai izrautos no šķidruma. Tas ik pa laikam arī notiek, un dažas molekulas, pārvarot savstarpējās mijiedarbības spēku, aizlido no šķidruma (1. att. a). Tā veidojas šķidruma tvaiki, un šo procesu sauc par iztvaikošanu. Iztvaikošana notiek jebkurā temperatūrā, tādēļ virs šķidruma vienmēr ir šķidruma tvaiki. Notiek arī iztvaikošanai pretējs process, kad virs šķidruma esošās molekulas atgriežas šķidrumā. Šo procesu sauc par kondensāciju.
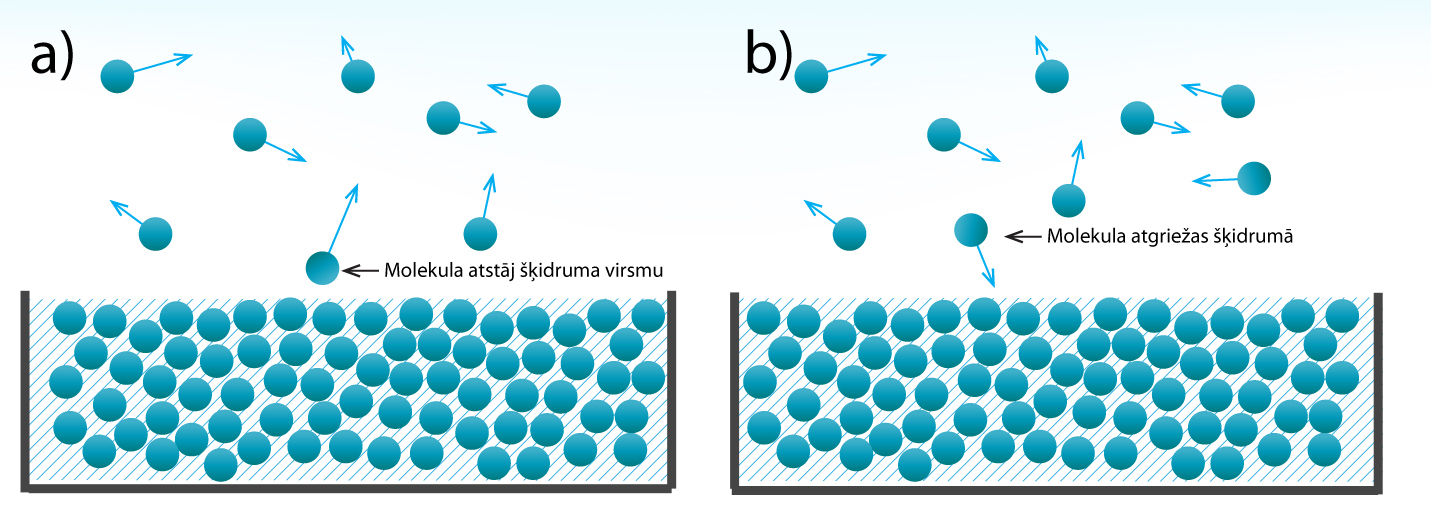
1.att. Šķidrumu iztvaikošana (a) un kondensēšanās (b)
Šķidruma iztvaikošana un kondensācija norit vienlaicīgi, bet šiem procesiem var būt atšķirīgi ātrumi. Ja šķidrumu, piemēram, ūdeni atstāj vaļējā traukā (2. att. a), tad pēc kāda laika ūdens no trauka pamazām “pazūd”, jo iztvaikošana ņem virsroku pār kondensāciju un ūdens pārvēršas tvaikā. Ja trauku ar šķidrumu noslēdz (2. att. b), tad šķidruma tvaiks uzkrājas trauka tilpumā, tādā veidā palielinot kondensācijas ātrumu. Pēc kāda laika iestājas dinamisks līdzsvars starp iztvaikošanu un kondesāciju jeb noteiktā laika momentā šķidrumu atstāj tikpat daudz molekulu, cik tajā atgriežas. Tvaiku, kas pakļauts šādam līdzsvaram, sauc par piesātinātu tvaiku. Vaļēja trauka (2. att. a) gadījumā, kad iztvaikošana noritēja ātrāk par kondensāciju, tvaiku sauc par nepiesātinātu tvaiku.
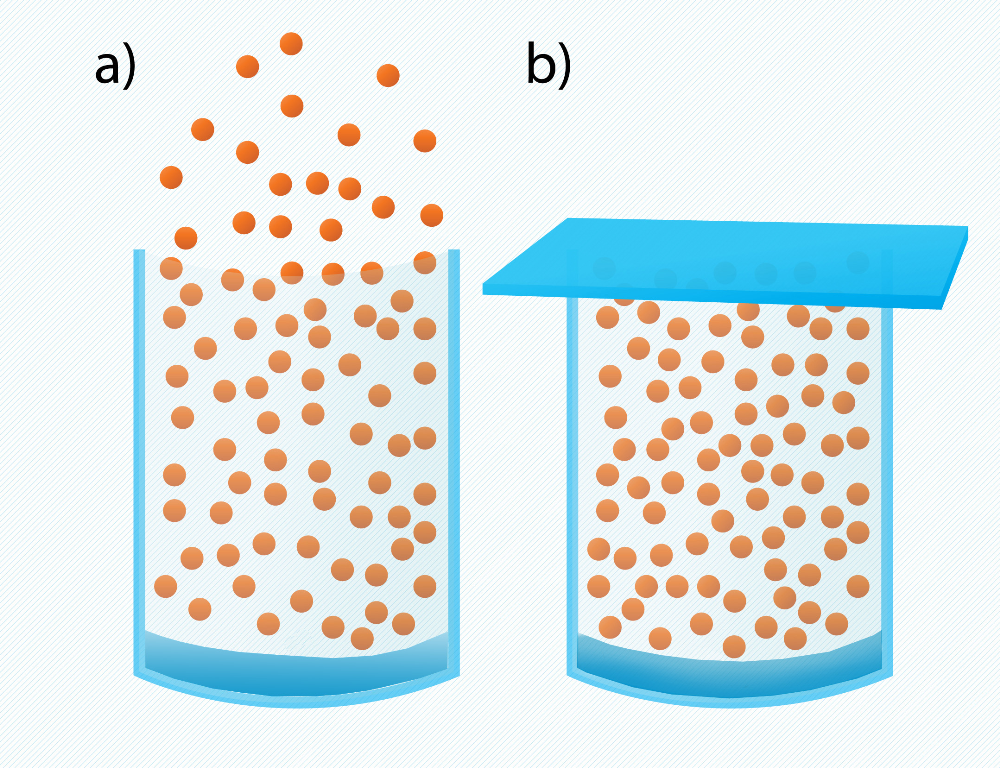
2.att. Tvaika veidošanās nenoslēgtā (a) un noslēgtā (b) traukā
Šķidruma iztvaikošana noris jebkurā temperatūrā, tomēr katram šķidrumam ir temperatūra, pie kuras tas sāk pastiprināti iztvaikot, un mēs sakām, ka šķidrums ir sācis vārīties, jo ir sasniegta vārīšanās temperatūra. Šķidruma vārīšanās ir speciāls iztvaikošanas veids. Piemēram, ja uz elektriskās plīts noliek katliņu ar ūdeni, tad, arī neieslēdzot plīti, laika gaitā viss ūdens no katliņa iztvaikos; bet, ja mēs elektrisko plīti ieslēdzam un ūdeni uzsildām līdz vārīšanās temperatūrai un turpinām to vārīt, tad viss ūdens no katliņa iztvaiko krietni ātrāk. Dažādiem šķidrumiem ir dažāda vārīšanās temperatūra (3. att.).
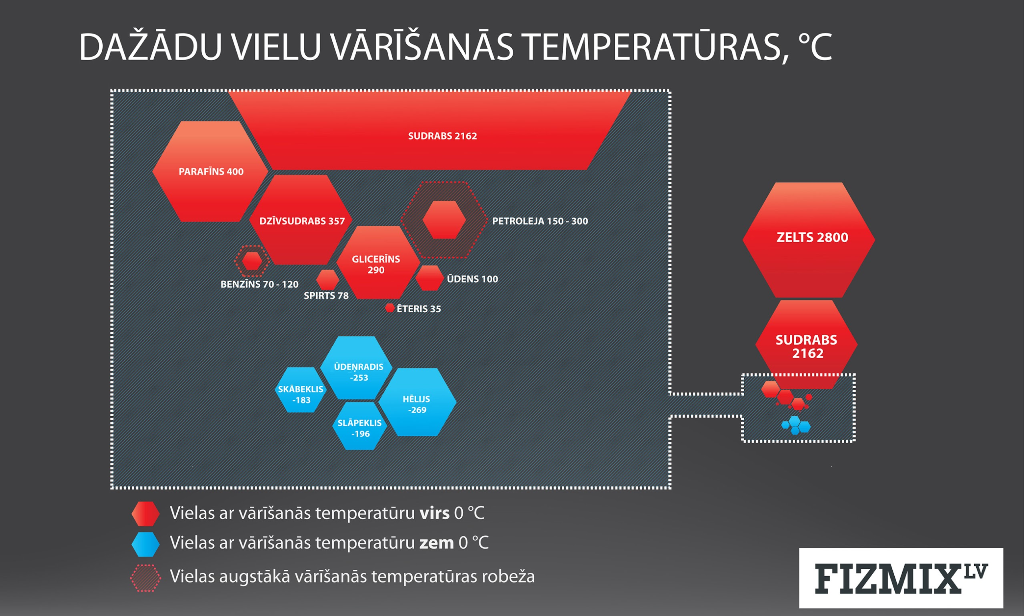
3.att. Dažādu šķidrumu vārīšanās temperatūras
Lai šķidruma molekulas izrautos no šķidruma un kļūtu par tvaiku, ir nepieciešama enerģija. Tā kā vārīšanās procesā iztvaikošanas notiek pastiprināti, tam ir nepieciešama krietna deva enerģijas, kas tiek pievadīta šķidrumam, to sildot. 4. attēlā redzams, kā mainās šķidruma temperatūra sildīšanas procesā. Kamēr šķidrums nav sasniedzis vārīšanās punktu, tā temperatūra pieaug pakāpeniski. Sasniedzot vārīšanās temperatūru, tā nemainās, līdz viss šķidrums ir iztvaikojis. Tas ir tādēļ, ka vārīšanās procesā tvaika un šķidruma temperatūras ir vienādas. Ja sildīšana turpinās arī pēc tam, kad viss šķidrums ir iztvaikojis, tad temperatūra atkal pieaug, jo uzsilst šķidruma tvaiks. Siltuma daudzumu Q, kas nepieciešams šķidruma pārvēršanai tvaikā, nosaka šķidruma masa m un īpatnējais iztvaikošanas siltums L, proti, Q = Lm. Dažādu šķidrumu īpatnējie iztvaikošanas siltumi apskatīti sadaļā par Siltuma daudzumu.
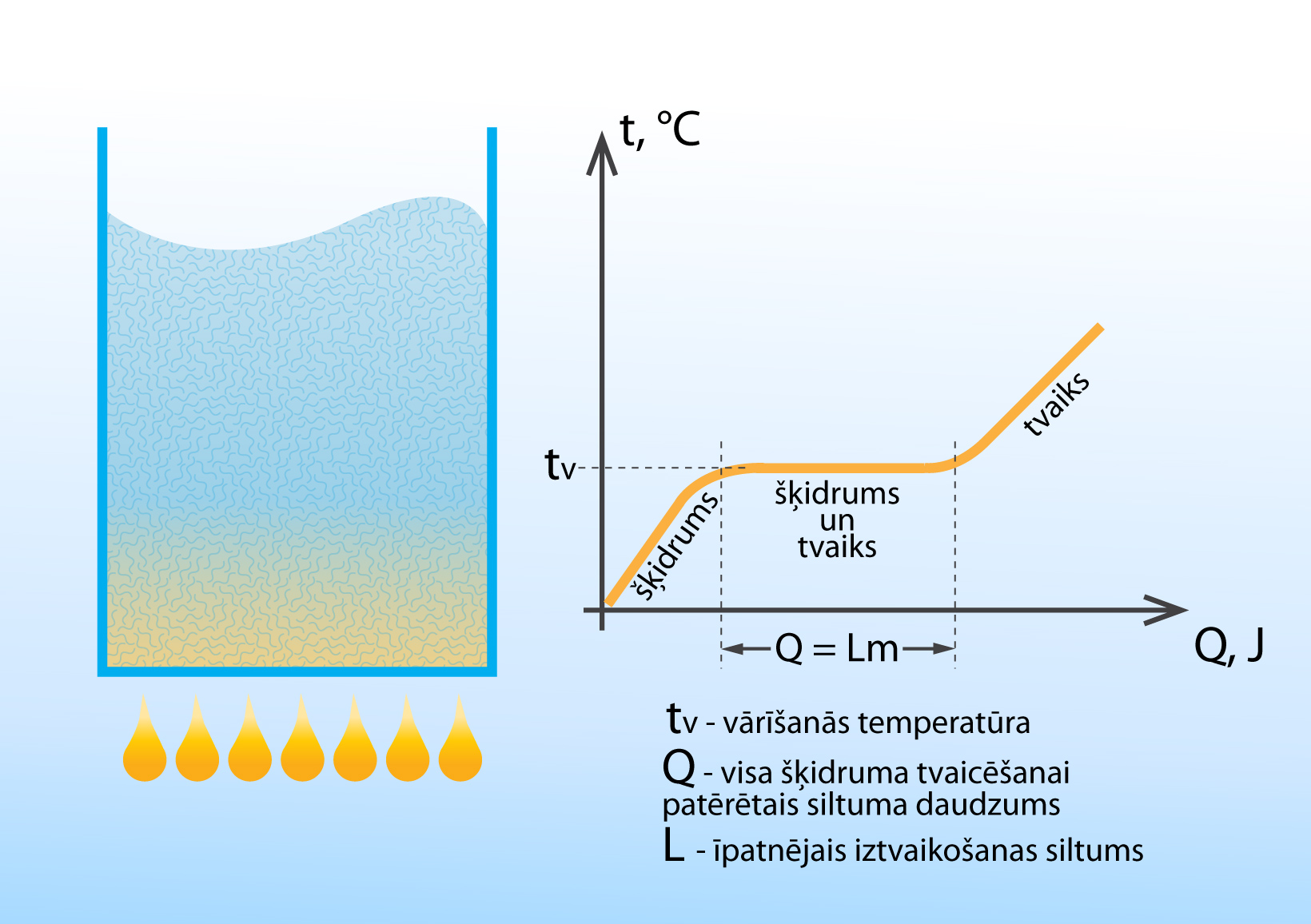
4.att. Šķidruma temperatūras maiņa sildīšanas procesā
Zeme ir ūdeņiem bagāta planēta. Ūdens nemitīgi iztvaiko gan no upēm, gan ezeriem, gan jūrām, okeāniem un citām ūdens krātuvēm, nonākot atmosfērā. Mēs šo ūdens tvaiku sajūtam kā gaisa mitrumu. Gaisa mitrumu var raksturot ar dažādiem lielumiem. Viens no tiem ir absolūtais gaisa mitrums a, kas raksturo to, cik liela ūdens tvaika masa atrodas 1 m3gaisa. Absolūto gaisa mitrumu aprēķina pēc formulas a = m : V, kur m ir ūdens tvaika masa, bet V ir apskatītais gaisa tilpums(5. att.). Absolūtajam gaisa mitrumam ir noteikta maksimāla vērtība, kas ir atkarīga no temperatūras, piemēram, pie temperatūras t = 20 ⁰C gaiss (1 m3gaisa) maksimāli var saturēt 17,6 g ūdens. Absolūtā mitruma mērvienība ir g : m3.
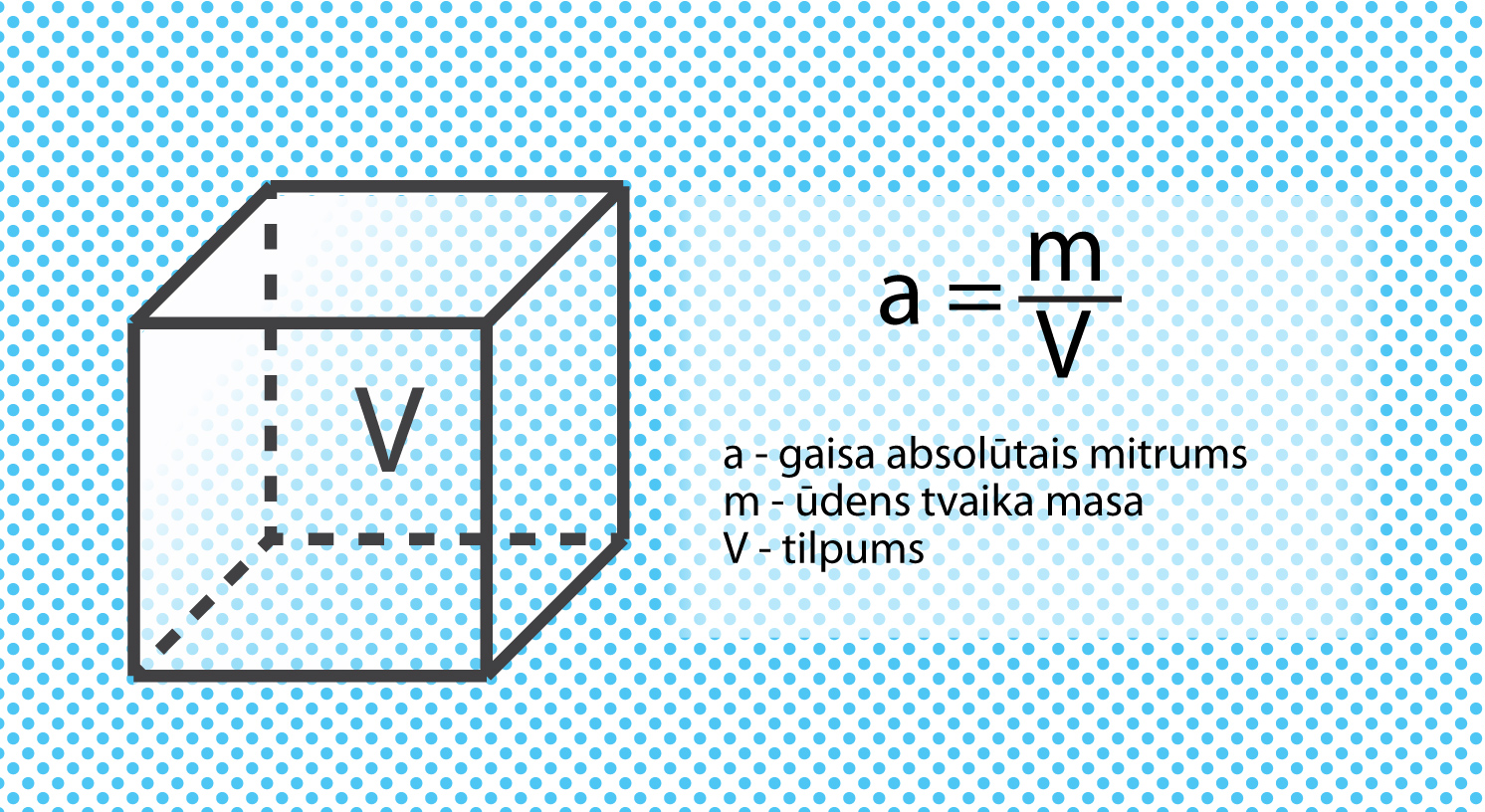
5.att. Gaisa absolūtais mitrums
Gaisa mitruma raksturošanai var lietot relatīvo gaisa mitrumu. Katra atmosfēras gāze rada savu spiedienu, ko sauc par parciālspiedienu. Ja visu atmosfēras gāzu parciālspiedienus saskaita kopā, tad iegūst atmosfēras spiedienu. Arī ūdens tvaikam ir savs parciālspiediens p. Ja šo parciālspiedienu izdala ar maksimāli iespējamo ūdens tvaika spiedienu p0, tad iegūst gaisa relatīvo mitrumu φ = p : p0.
6. attēlā ir ilustrēts relatīvais gaisa mitrums. Ar zilu krāsu ir atzīmēts ūdens tvaika parciālspiediens, bet ar dzelteno krāsu maksimāli iespējamais ūdens tvaika spiediens. Pieaugot temperatūrai, pieaug maksimāli iespējamais ūdens tvaika spiediens, tādēļ, ja ūdens tvaika spiediens nemainās, tad relatīvais mitrums samazinās. Relatīvo mitrumu parasti izsaka procentos φ = p : p0. 100%.
Apskaties pārbaudītu Wikipedia.org rakstu par gaisa mitrumu!
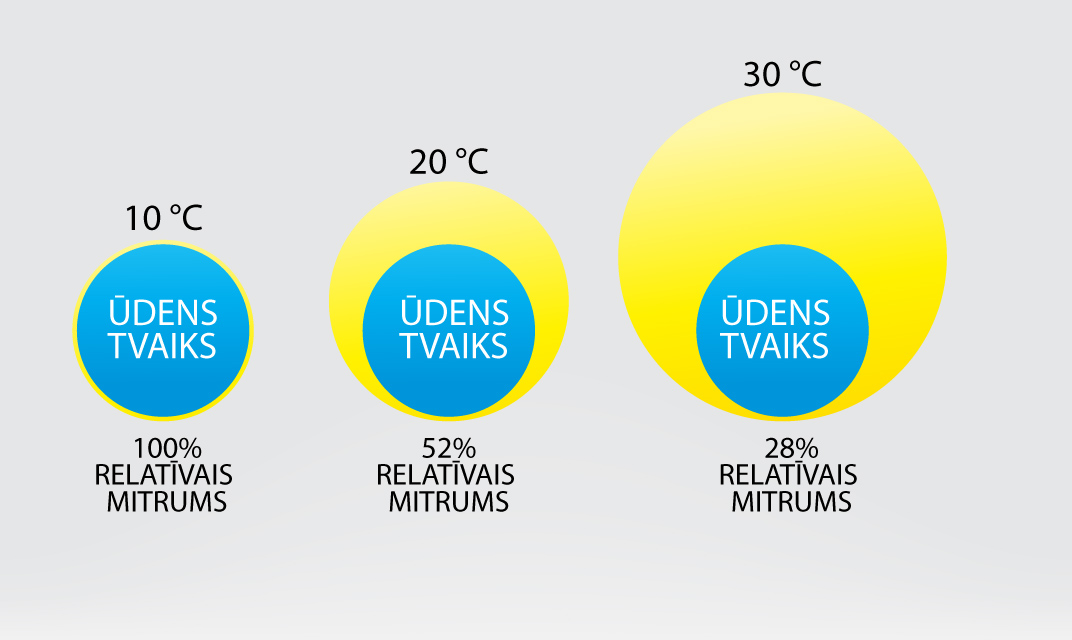
6.att. Gaisa relatīvais mitrums
Kā jau iepriekšējā solī tika minēts, atmosfēras spiedienu veido katras tās sastāvā esošās gāzes parciālspiediens. Piemēram, ja mums būtu gāzu maisījums, kas sastāvētu no ūdens tvaika un skābekļa, un tā spiediens būtu pkopā, tad šo kopējo gāzes spiedienu veidotu katras atsevišķās gāzes radītais parciālspiediens (1. att.). Protams, atmosfēru veido vairāk nekā divas gāzes, tāpēc atmosfēras spiediens veidojas no daudzu gāzu parciālspiedieniem. Nosakot gaisa relatīvo mitrumu φ = p : p0, mums ir svarīgs atmosfērā esošā ūdens tvaika parciālspiediens. Ūdens tvaika spiedienu var aprēķināt no gāzes stāvokļa vienādojuma, iegūstot, ka p = aRT : M, kur
p - ūdens tvaika parciālspiediens
a - absolūtais mitrums
R - universālā gāzu konstante
M - ūdens molmasa
T – gāzes temperatūra
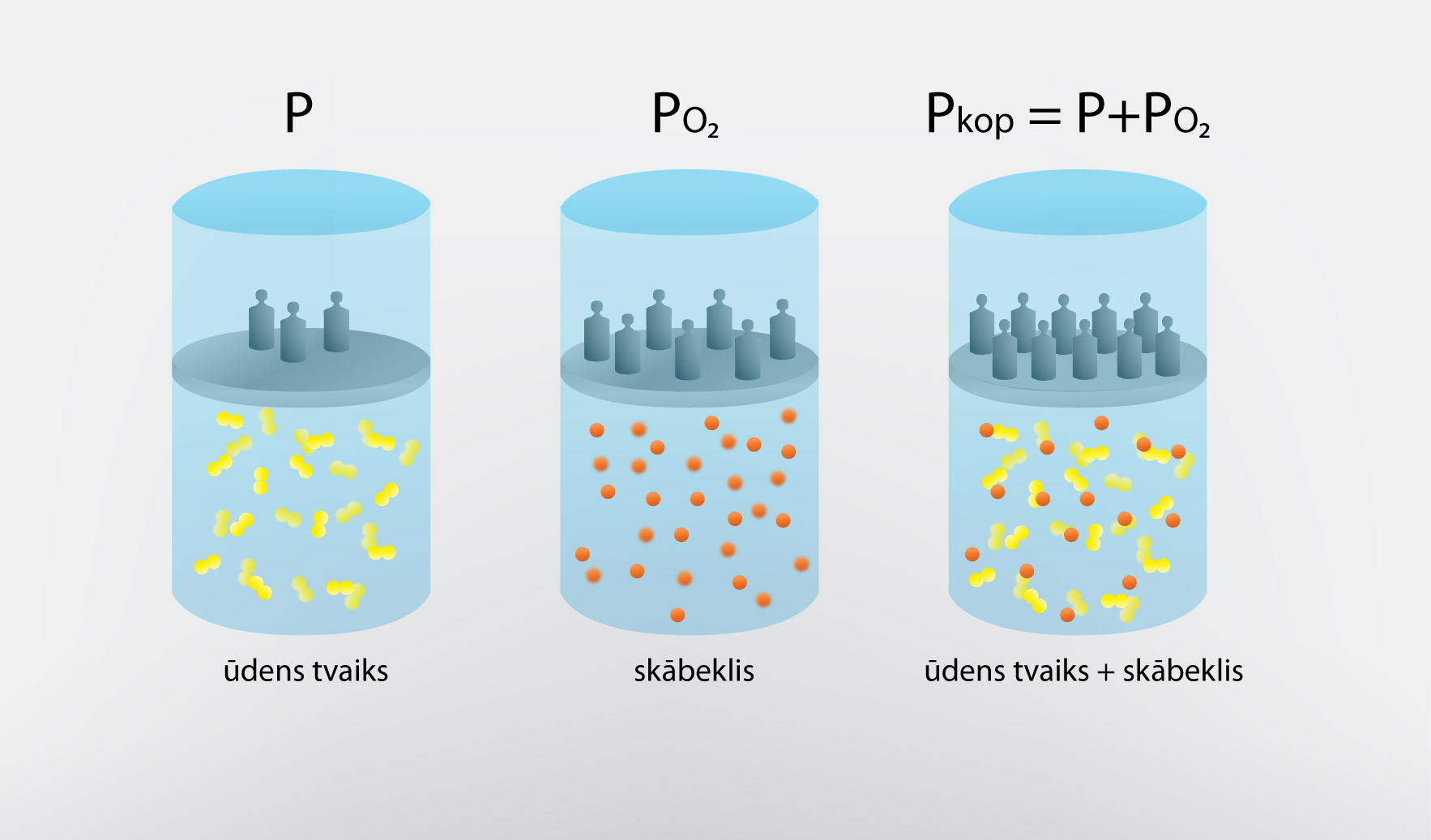
1.att. Gāzu maisījuma kopējais spiediens veidojas, summējoties katras gāzes pārciālspiedieniem
Gaisa mitruma raksturošanai var lietot arī rasas punktu. Par rasas punktu sauc temperatūru, līdz kurai atdzesējot ūdens tvaiku, tas kļūst piesātināts un sāk kondensēties, veidojot rasas pilieniņus. Rasas punkta sasniegšanu var novērot skaidrās vasaras naktīs, kad, pazeminoties gaisa temperatūrai, rasa veidojas gan uz augiem, gan, piemēram, zirnekļu tīkliem (2. att.).

2.att. Gaisa temperatūrai sasniedzot rasas punktu, sāk veidoties rasa
Rasas punktu var izmantot, lai noteiktu gaisa mitrumu. Šādas mitruma noteikšanas ierīces sauc par kondensācijas higrometriem, un tajos tiek dzesēta spoguļvirsma, līdz uz tās parādās rasas pilieniņi, pēc tam tiek nolasīta gaisa mitruma vērtība. Tomēr daudz vienkāršāka uzbūve ir, piemēram, mata higrometriem, kuros izmanto faktu, ka mata garums mainās atkarībā no gaisa mitruma. Ja matam pievieno sviru, kas kustas matu garuma izmaiņas ietekmē, tad, veicot graduēšanu, var iegūt gaisa mitruma mērierīci (3. att.).
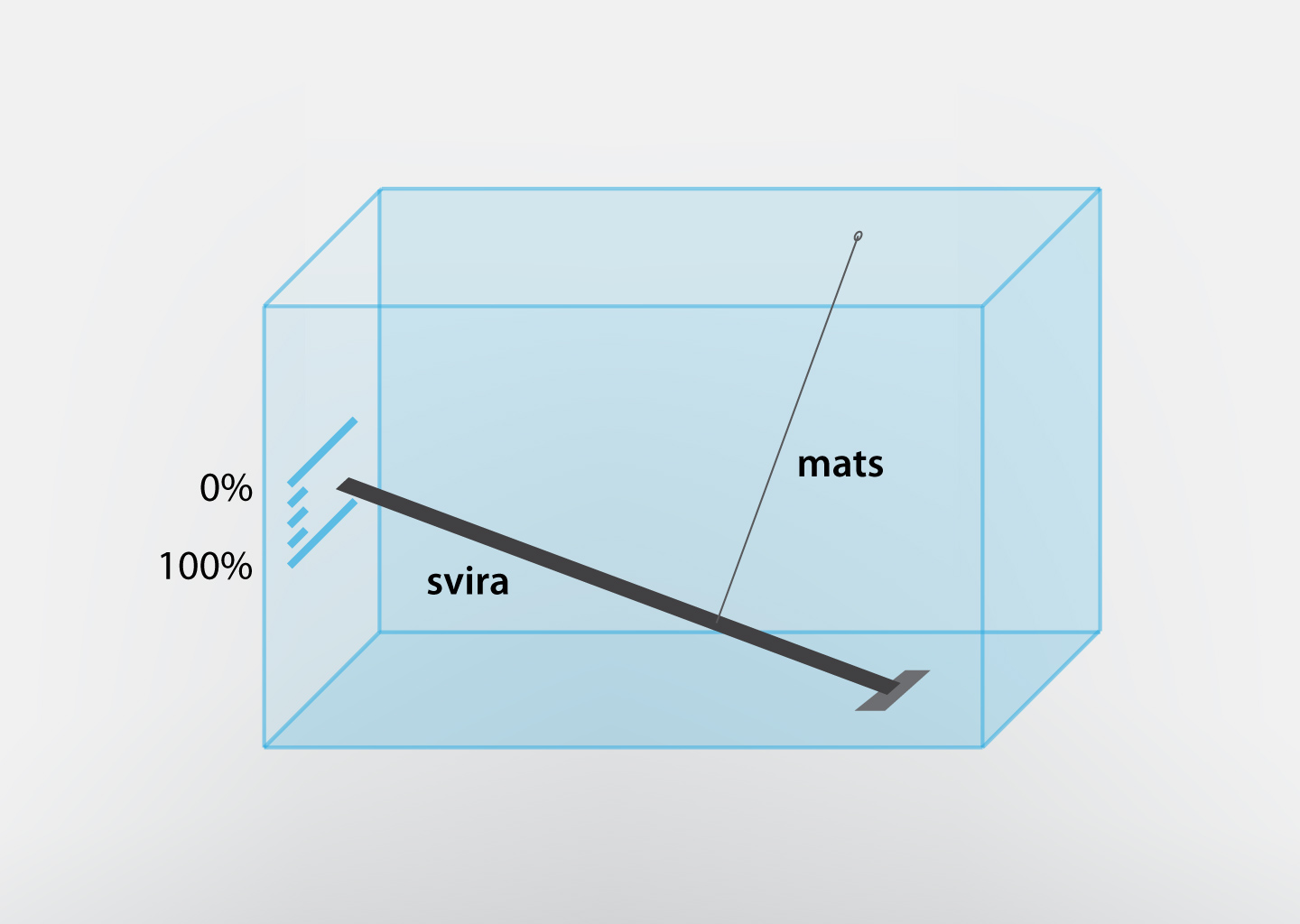
3.att. Paštaisīta mata higrometra uzbūve
Līdzīgi kā rasas punkts ir atkarīgs no gaisa mitruma, piesātināta ūdens tvaika spiediens ir atkarīgs no temperatūras. Pieaugot temperatūrai, piesātinātā ūdens tvaika spiediens palielinās (4. att.). Tas nozīmē: jo augstāka ir temperatūra, jo vairāk ūdens tvaika spēj sevī saturēt atmosfēra, nepārvēršot to rasas pilienos. Ja apskata grafisko sakarību (4.att.), tad var redzēt, ka 100 oC atbilst 1 atmosfēru liels spiediens jeb 760 mmHg. Šī sakritība ar ūdens vārīšanās temperatūru normālā atmosfēras spiedienā nav nejauša. Izrādās, ka šķidrums vārās tad, kad šķidruma piesātināta tvaika spiediens sakrīt ar atmosfēras spiedienu, un tādēļ vārīšanas temperatūra ir atkarīga no apkārtējā spiediena.
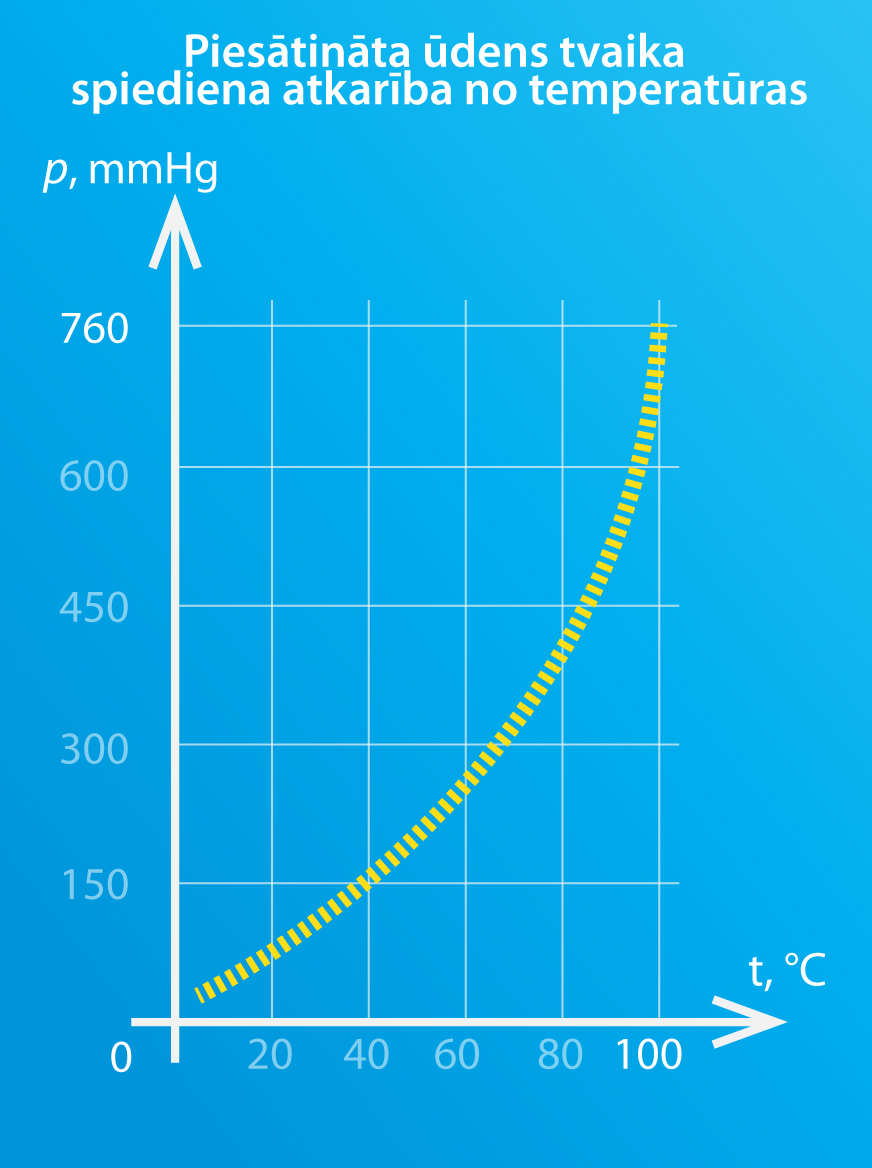
4.att. Piesātināta ūdens tvaika spiediena atkarība no temperatūras
Ikdienā mēs esam pieraduši dzīvot normālā atmosfēras spiedienā, tādēļ mums šķiet pašsaprotami, ka ūdens sāk vārīties pie 100 oC temperatūras. Bet cilvēkiem, kas dzīvo augstāk virs jūras līmeņa vai arī kāpj kalnos, situācija ir atšķirīga. Palielinoties augstumam virs jūras līmeņa, atmosfēras spiediens samazinās un līdz ar to samazinās ūdens vārīšanās temperatūra (5. att). Uzkāpjot augstākajā Zemes kalnā Everestā, ūdens vārīšanās temperatūra ir tikai 70 oC.
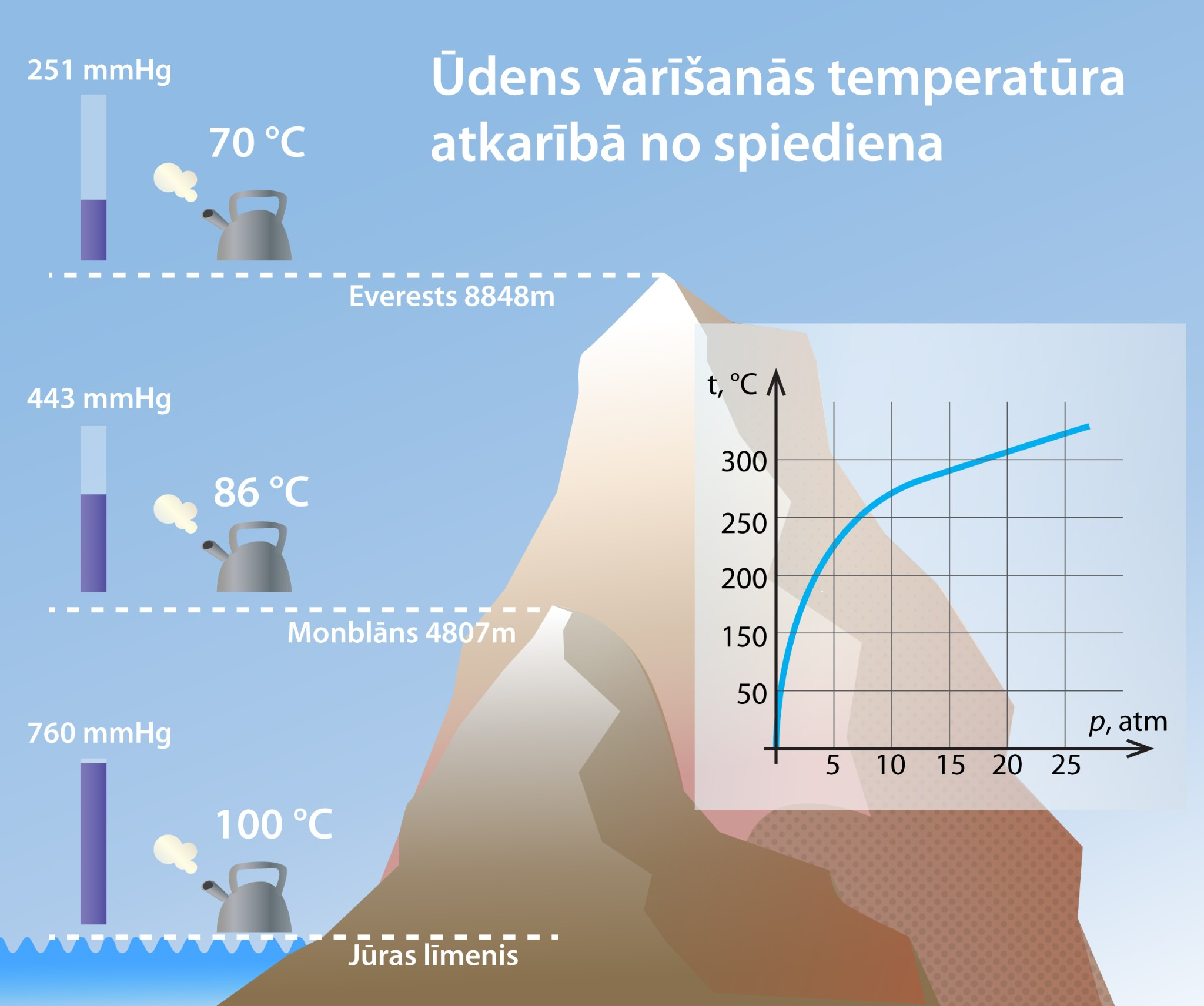
5.att. Ūdens vārīšanās temperatūras atkarība no spiediena
Ja traukā ielej šķidrumu un virs tā novieto virzuli (1. att. a), tad var iegūt sistēmu, ar kuru iespējams novērot tvaika īpašības. Ja virzuli lēnām sāks vilkt uz augšu, tad virs šķidruma izveidosies piesātināts tvaiks (1. att. b). Jo augstāk virzuli bīda, jo lielāka daļa no šķidruma pārvēršas par piesātinātu tvaiku līdz brīdim, kad viss šķidrums ir izzudis un trauku zem virzuļa piepilda piesātināts tvaiks (1. att. c). Ja virzuli turpina virzīt uz augšu, tad tvaiks kļūst nepiesātināts (1. att. d).
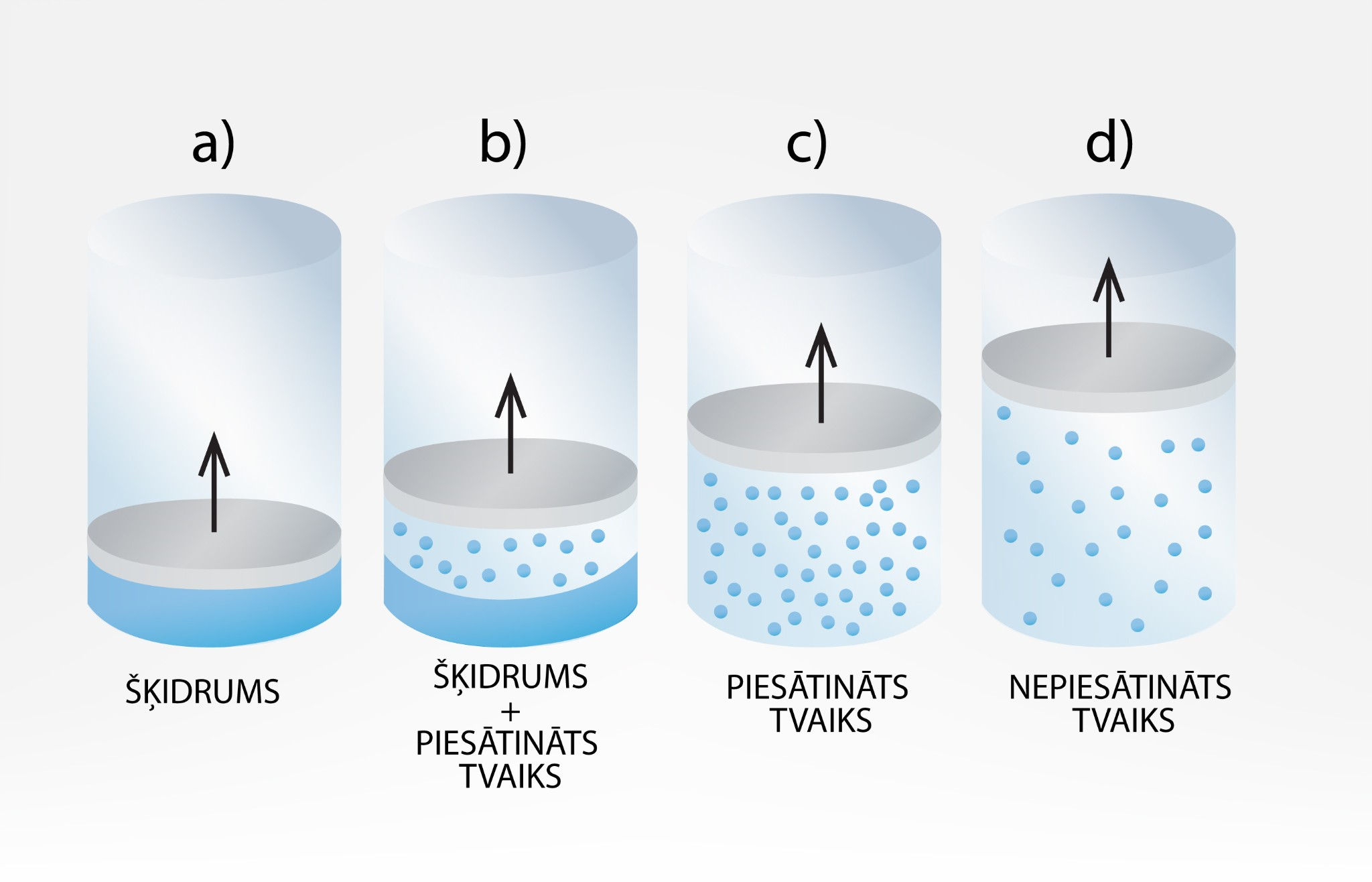
1.att. Tvaiks virs šķidruma noslēgtā sistēmā
Ja mēs iepriekš apskatītajai sistēmai uzzīmētu grafiku tvaika spiediena atkarībai no sistēmas tilpuma, tad iegūtu 2. attēlā redzamo ainu. Līdz pat stāvoklim c (1. att, c) tvaika spiediens nemainās, jo tas visu šo posmu ir piesātināts, un piesātināta tvaika spiediens ir atkarīgs no temperatūras, kas šajā gadījumā nemainās. Pēc tam tvaiks kļūst nepiesātināts un tā spiediens pakļaujas Boila – Mariota likumam.
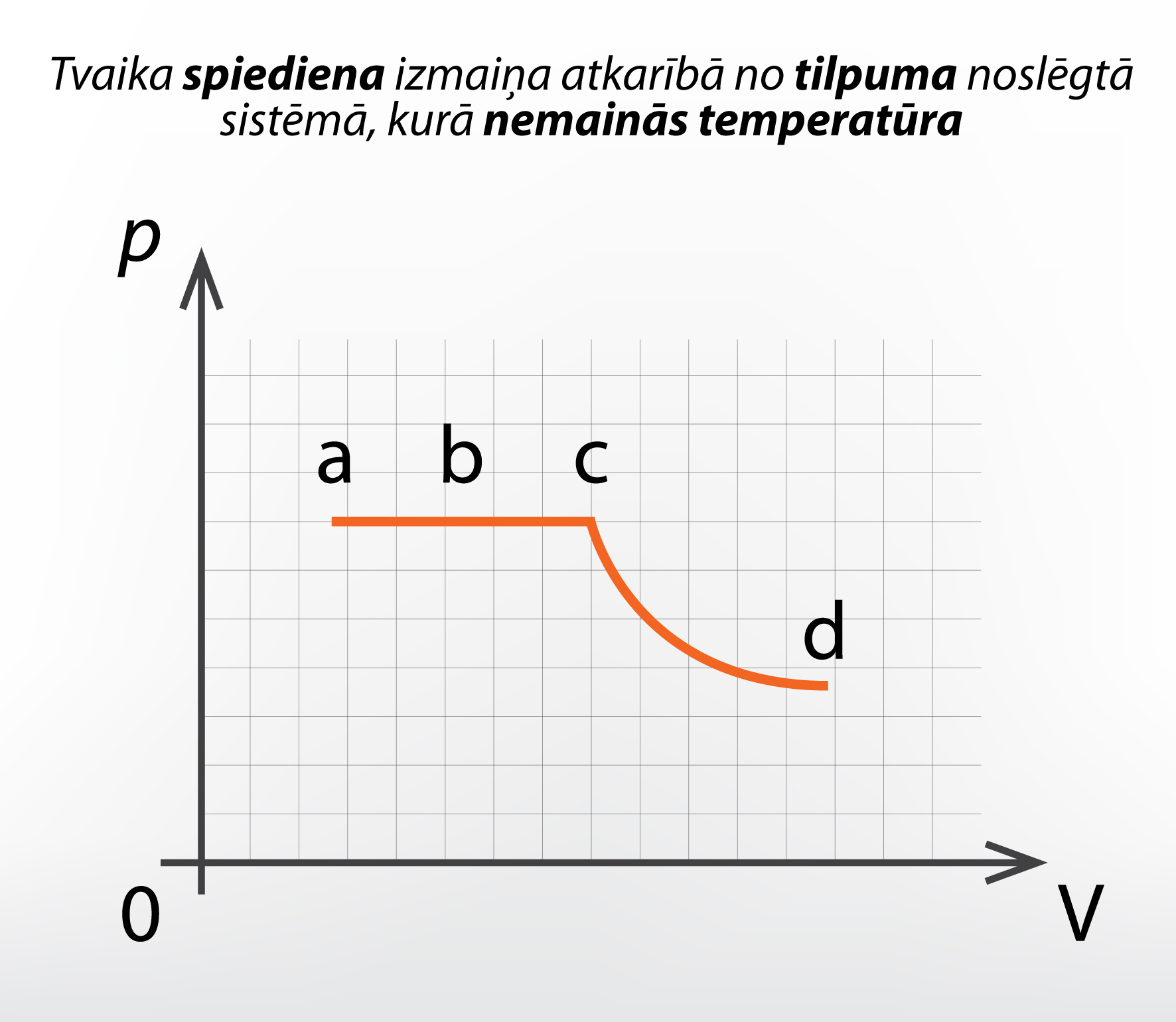
2.att. Tvaika spiediena izmaiņa, ja...
Kā jau minēts, piesātināta tvaika spiediens un arī nepiesātināta tvaika spiediens ir atkarīgs no temperatūras. Ja mēs iepriekš apskatīto sistēmu nofiksējam, lai tās tilpums nemainās, un mainām sistēmas temperatūru (3. att.), tad šādā sistēmā tvaika spiediens atkarībā no temperatūras mainās tā, kā parādīts 3. att. Posmā a-b tvaiks ir nepiesātināts un spiediens mainās divu iemeslu dēļ:
1) palielinās tvaika molekulu haotiskās kustības ātrums,
2) palielinās tvaika molekulu skaits.
Posmā b-c tvaiks ir piesātināts, tādēļ spiediens palielinās tikai uz molekulu haotiskās kustības ātruma pieauguma rēķina. Nepiesātināta tvaika spiediens, salīdzinot ar piesātinātu, mainās vairāk iemeslu dēļ, tādēļ arī spiediens pieaug straujāk, kā tas arī redzams 3. att.
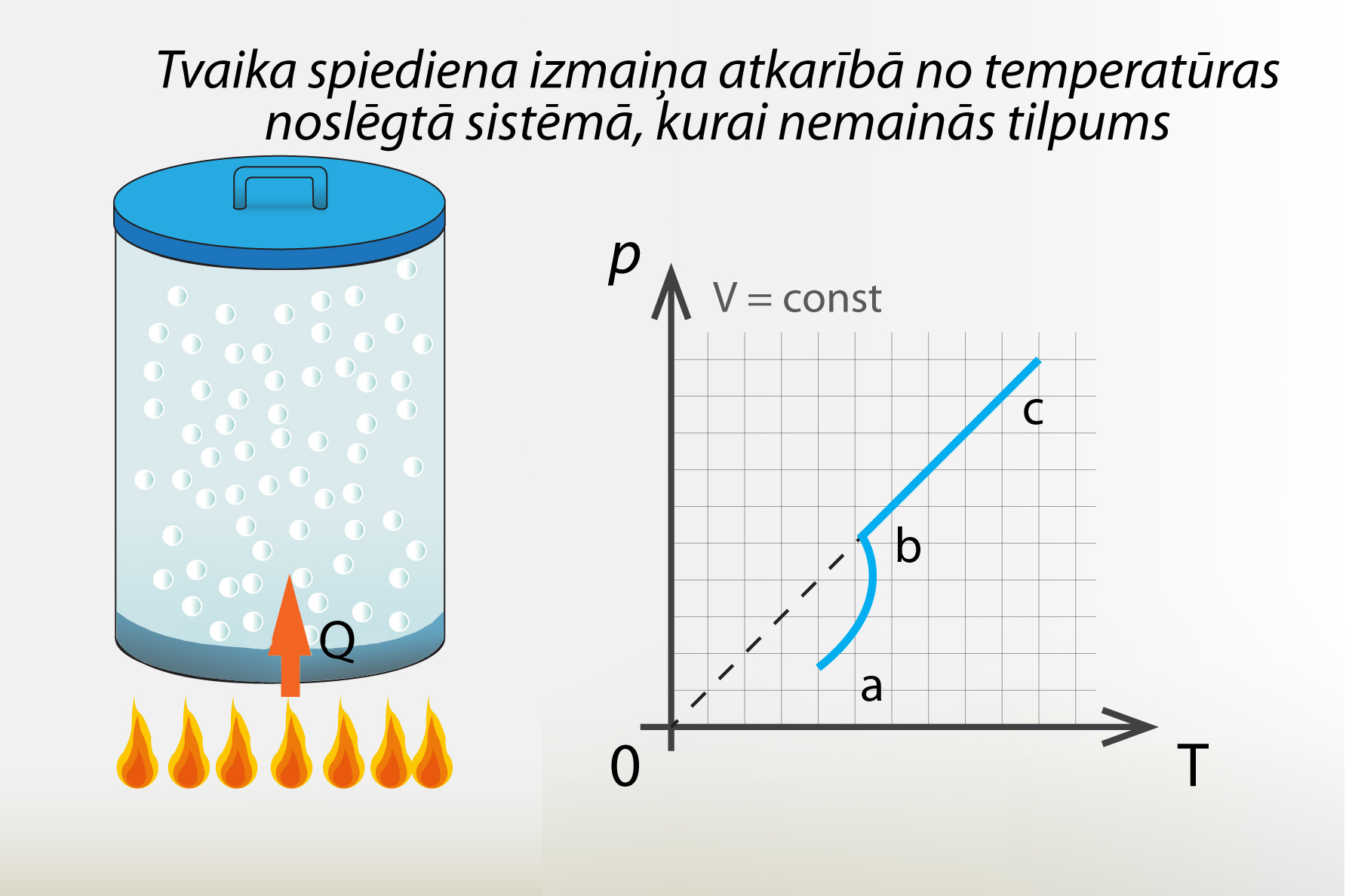
3.att. Tvaika spiediena izmaiņa, ja …
Apskatot tuvāk, kas notiek vārīšanās procesā, ir redzams, ka šķidrums aktīvi burbuļo jeb no tā izdalās burbuļi. Tas ir tādēļ, ka sākotnēji šķidrumā atrodas ļoti mazi šķidruma un gaisa pūslīši, kas ar aci nav saskatāmi, bet tur ir. Kad šķidrumam paaugstinās temperatūra, šie pūslīši kļūst lielāki un piepildās ar šķidruma tvaiku. Uz pūslīti šķidrumā darbojas divi pretēji vērsti spēki: smaguma spēks mg virza pūslīti virzienā uz trauka dibenu, bet Arhimēda spēks FAceļ pūslīti augšup (4. att.). Pieaugot pūslīša tilpumam, Arhimēda spēks pieaug, līdz tiek pārvarēts smaguma spēks, un tad pūslītis sāk celties augšup.
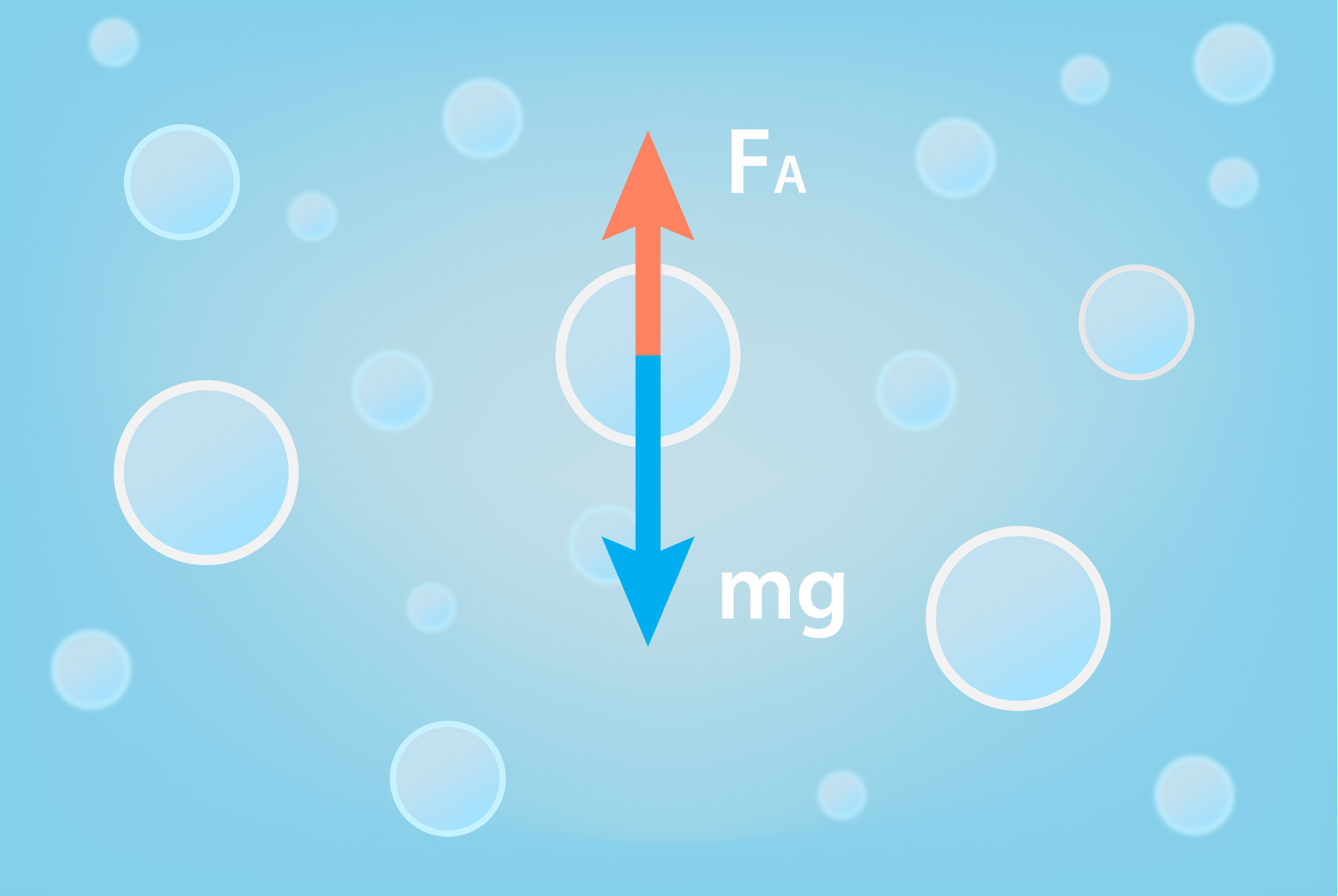
4.att. Uz tvaika pūslīti šķidrumā darbojas divi pretēji vērsti spēki
Uz tvaika pūslīti šķidrumā darbojas ne tikai dažādi spēki, bet arī dažādas izcelsmes spiedieni, kuru summa nosaka pūlsītī esošā tvaika spiedienu p. Pirmkārt, p ietekmē apkārtējās vides spiediens p0, kas vaļēja trauka gadījumā ir atmosfēras spiediens (5. att.).
Atkarībā no pūslīša dziļuma h uz to darbojas hidrostatiskais spiediens pH = ρgh, kur
ρ - šķidruma blīvums
g - smaguma spēks
h - pūslīša dziļums
pH - hidrostatiskais spiediens
Pūslīša virsma ir liekta, tādēļ uz to darbojas papildspiediens pp = 2σ : R, kur
σ - virsmas spraiguma koeficients
R - pūslīša rādiuss
Šo spiedienu summa veido pūslītī esošā tvaika spiedienu p = p0 + pH + pp.
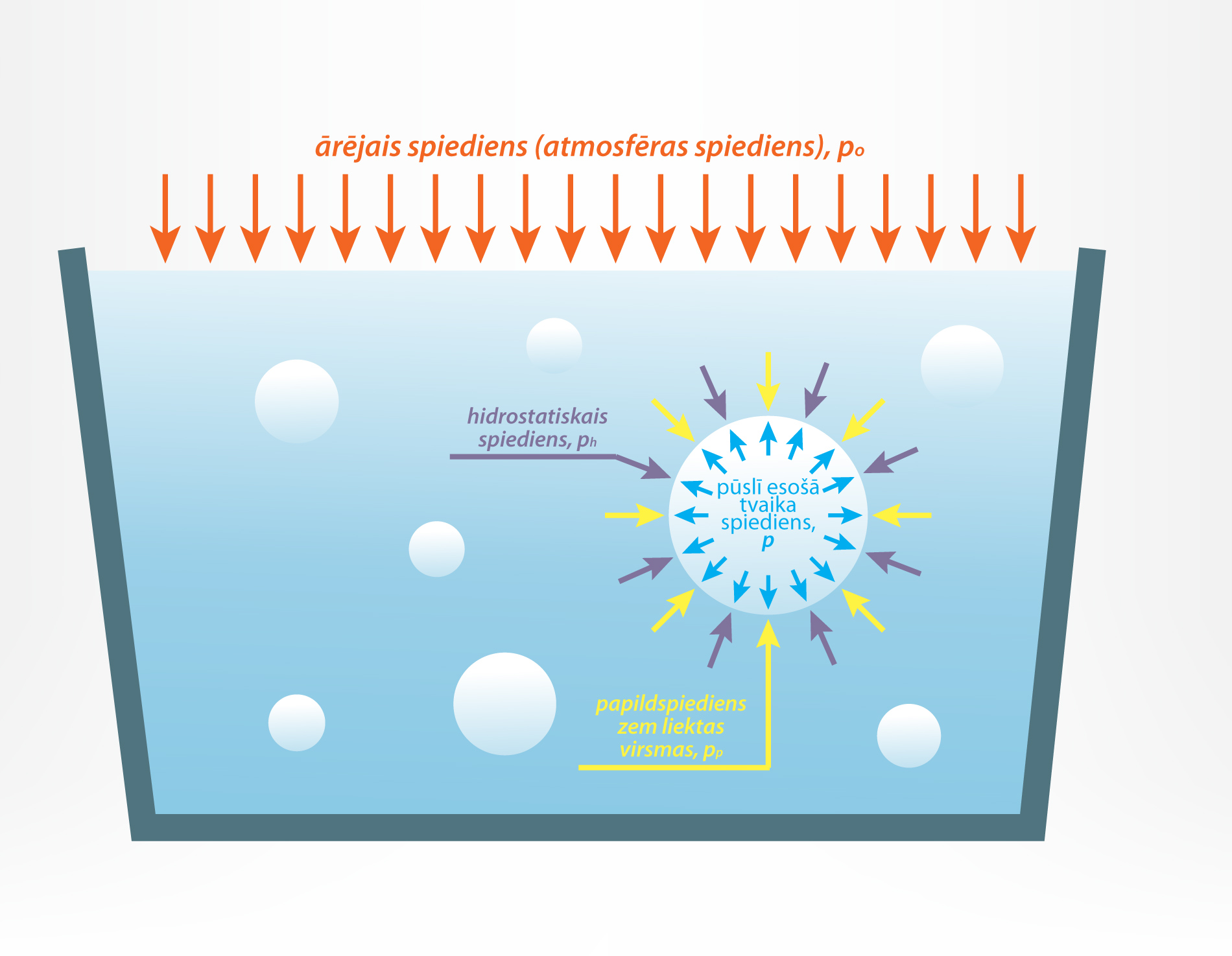
5.att. Uz pūslīti darbojošies spiedieni