Visa pasaule ir viens liels konstruktors, jo visi ķermeņi ir veidoti no atomiem. Aplūkojot ķīmisko elementu periodisko tabulu, var redzēt, ka dažādo atomu skaits tikai nedaudz pārsniedz simtu, no kuriem dabā sastopami pirmie 92. Atoms sastāv no pozitīvi lādēta kodola, ap kuru atrodas negatīvi lādēts elektronu apvalks (1. att. a). Neitrālā atomā elektronu skaits ir vienāds ar ķīmiskā elementa kārtas numuru Z ķīmisko elementu periodiskajā tabulā (1. att. b). Piemēram, litijam (Li) ir kārtas numurs 3, līdz ar to ap neitrāla Li atoma kodolu atrodas trīs elektroni (1. att.). Viena elektrona lādiņš ir vienāds ar elementārlādiņu e = 1,6 · 10-19C. Līdz ar to kopējais elektronu lādiņš atomam vienāds ar Z · e.
Apskaties DZM materiālu par šo tēmu!
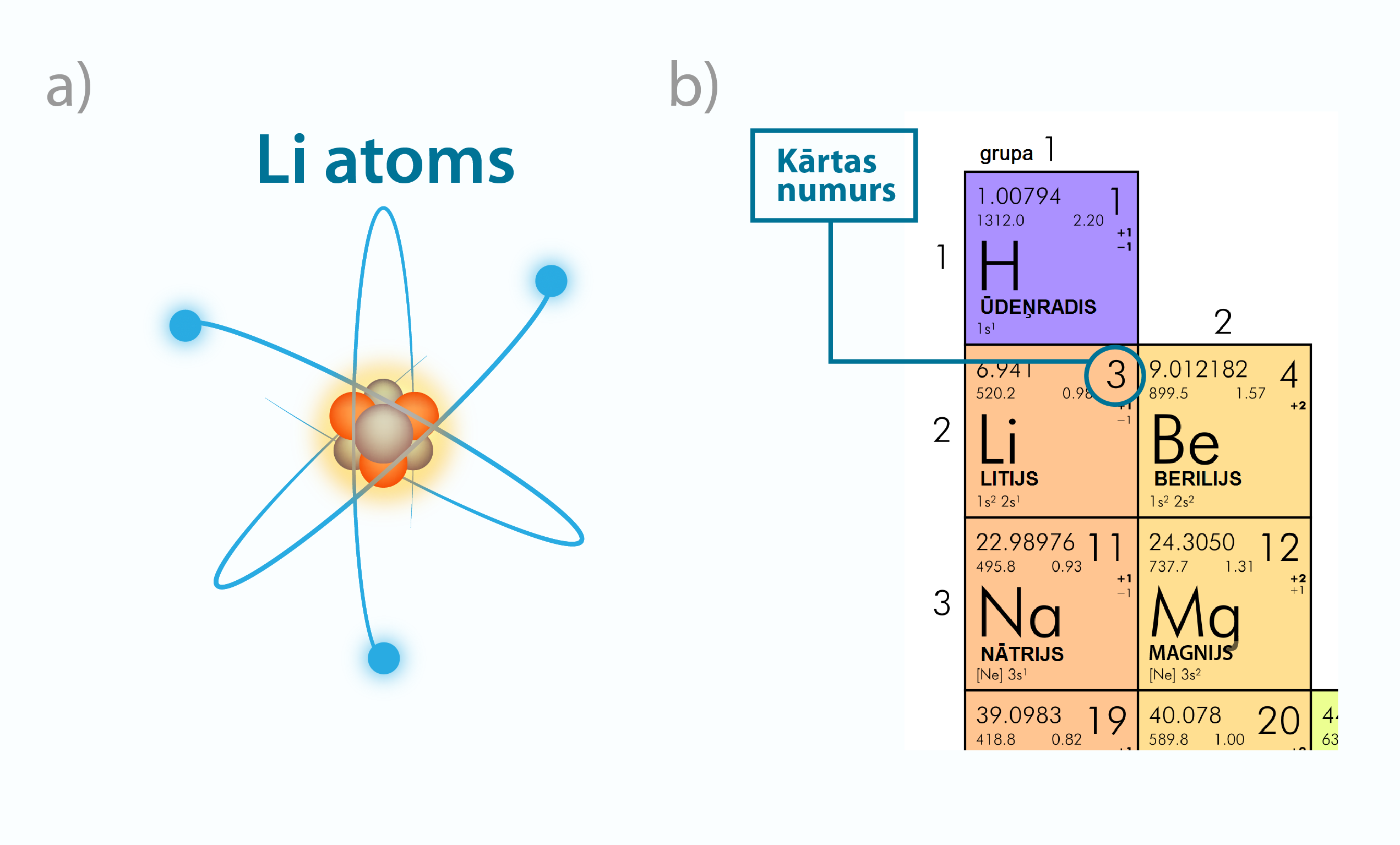
1.att. Atoms un tā raksturlielumi ķīmisko elementu periodiskajā tabulā
Pozitīvo lādiņu nodrošina protoni, kuru lādiņa lielums ir vienliels ar elektrona lādiņu, tikai ar pretēju zīmi (2. att. a), tādēļ neitrālā atomā protonu un elektronu skaits ir vienāds. Neitroniem lādiņš nepiemīt, tādēļ to skaits neitrālā atomā var būt dažāds. Atoma izmērs ir aptuveni 10-10m, un kodola izmērs ir tikai aptuveni 10-14m (2. att. b). Lai gan kodols ir tik mazs, tajā ir koncentrēta gandrīz visa atoma masa, jo kodols ir veidots no protoniem un neitroniem, kas ir daudz smagāki par elektroniem. Viens protons sver aptuveni tikpat, cik 1836 elektronu (2. att. b). Tas nozīmē: ja elektrons svērtu vienu kilogramu, tad protons svērtu teju divas tonnas. Tajā pašā laikā neitrona un protona masa ir aptuveni vienāda (2. att. c). Lai atoms būtu elektriski neitrāls, kodolam ir jābūt pozitīvi lādētam.
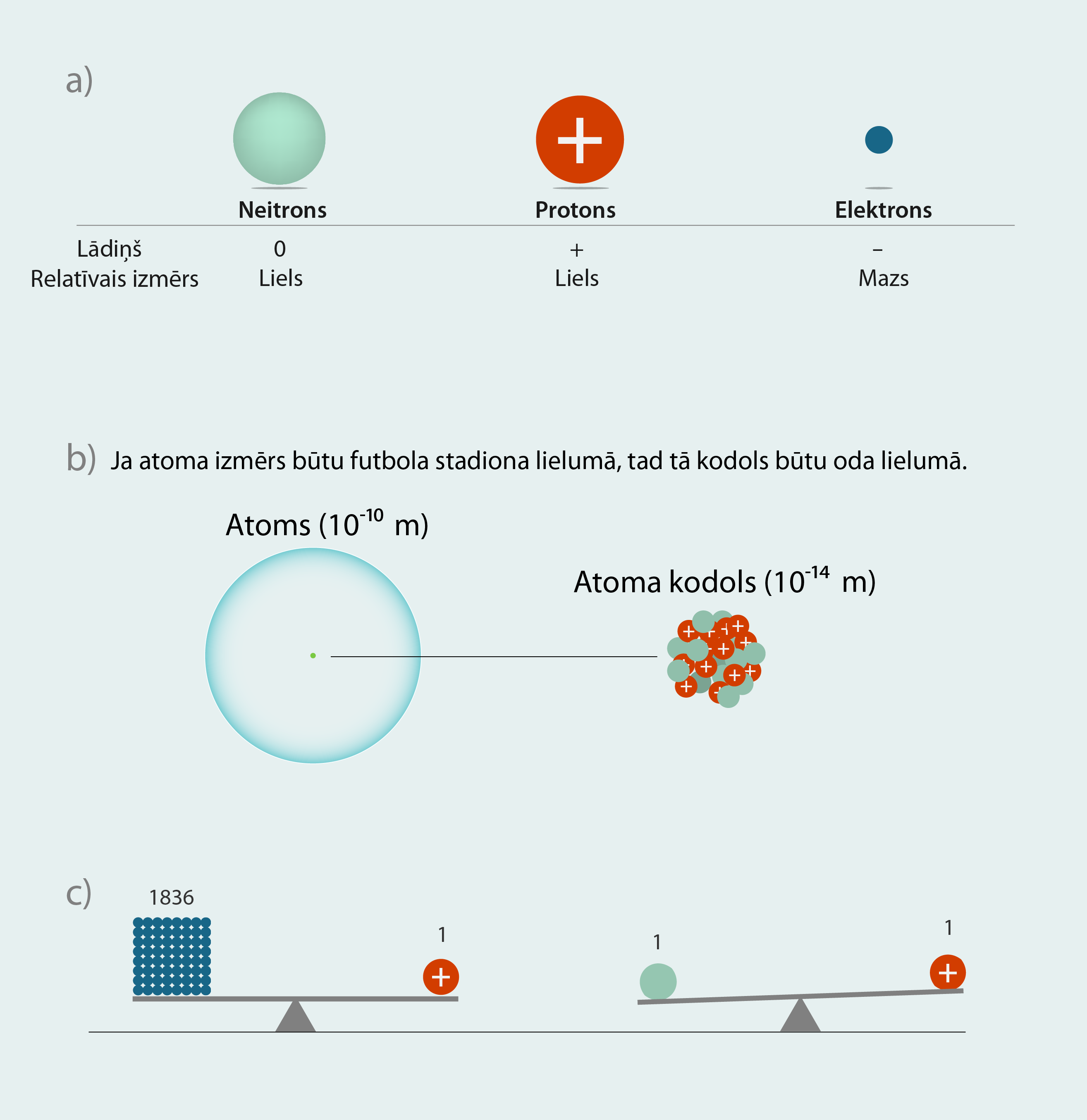
2.att. Atoma uzbūves elementi
Pieaugot ķīmiskā elementa kārtas skaitlim, pieaug kodolā esošo protonu skaits un elektronu daudzums ap to. Ja pirmajam ķīmiskajam elementam – ūdeņradim – ir viens protons un viens elektrons, tad hēlijam jau katra no šīm daļiņām ir pa divi, bet litija atomā atrodas trīs protoni un trīs elektroni (3. att.).
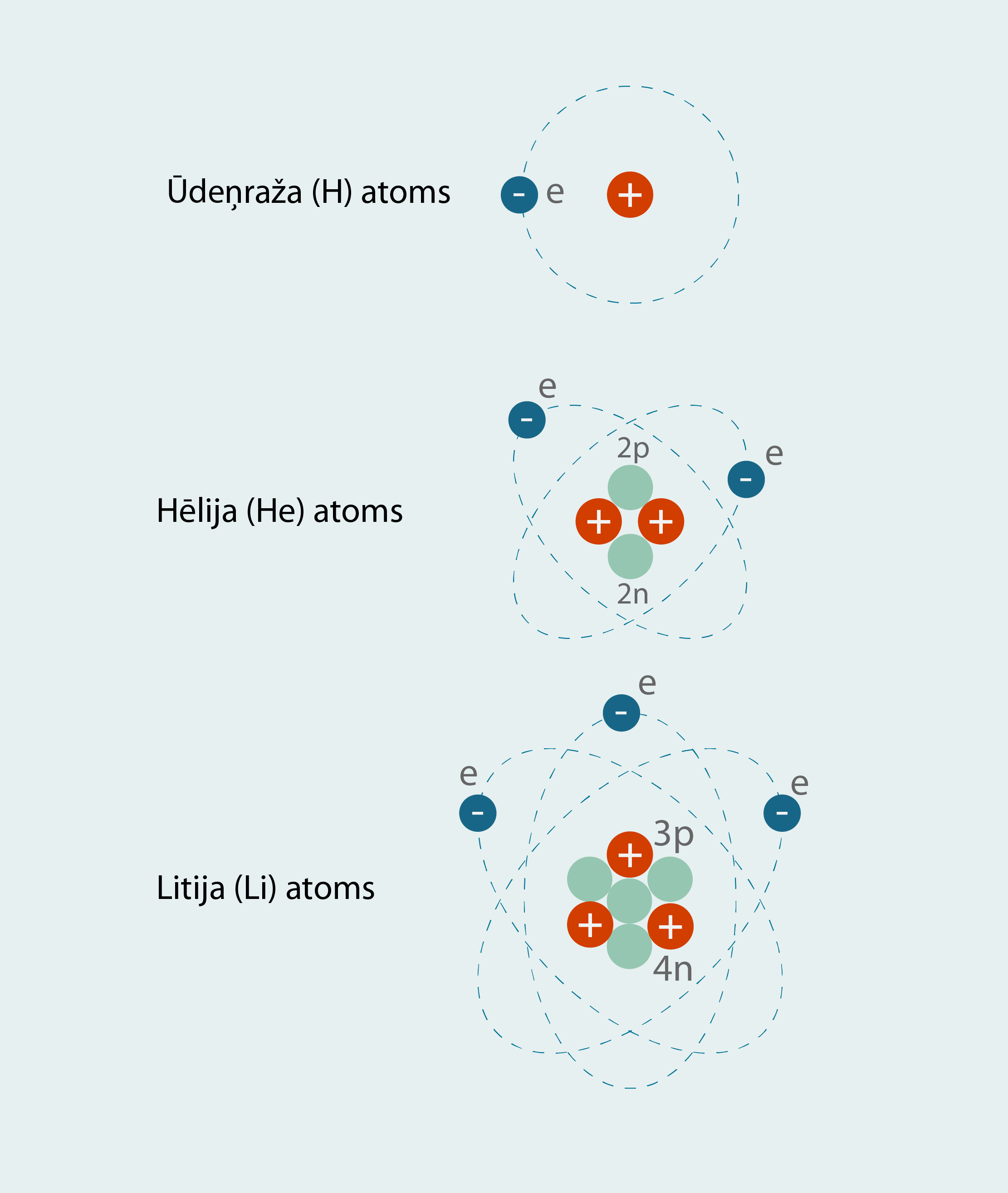
3.att. Atoma uzbūves elementi
Atoma kodols tika atklāts, apšaudot zelta foliju ar alfa daļiņām un konstatējot, ka dažas alfa daļiņas tiek stipri noliektas un pat atsistas gandrīz pilnībā atpakaļ (Atoma uzbūve); tas liecina par mazu, bet masīvu objektu atoma centrā, kas vēlāk izrādījās atoma kodols. Tikai vēlāk noskaidrojās, ka alfa daļiņas patiesībā ir hēlija atoma kodoli, kas sastāv no diviem protoniem un diviem neitroniem (2. att. a). Hēlijs ķīmisko elementu periodiskajā tabulā atrodas pašā sākumā, tādēļ tā kodolā nav liels nuklonu skaits, taču, pieaugot elementa kārtas skaitlim, nuklonu skaits pakāpeniski pieaug. Tādēļ attēlot, piemēram, urāna kodolu ir daudz grūtāk, jo tajā ir vairāk nekā 200 nuklonu (2. att.).
Lai veiktu aptuvenu atoma izmēru aprēķinu, var izmantot Avogadro skaitli NA(Vielu uzbūve, molekulu siltumkustība). Ja atomus iedomājas kā apaļas bumbiņas ar diametru d, kuras sabērtas kastē (1. att.), tad katra bumbiņa (katrs atoms) aizņem kubveida tilpumu d3 (1. att.). Līdzīgi atomi izkārtojas arī vielā. Piemēram, dzelzs molmasa ir 0,056 kg/mol, bet blīvums ρ = 7800 kg/m3. Blīvumu ρ, tilpumu V un masu m saista sakarība ρV = m, līdz ar to tilpumu var izteikt kā V = m : ρ. Tas nozīmē, ka viens mols dzelža ieņem tilpumu V = 0,056 : 7800 = 7,18 · 10-6 m3. Ja viens dzelzs atoms aizņem tilpumu d3, tad viens mola tilpums ir d3 · NA = d3 · 6,02 · 1023. Līdz ar to d3 · 6,02 · 1023 = 7,18 · 10-6, no kurienes d3 = 7,18 ·10-6 : 6,02 · 1023 = 11,93 · 10-30 m3.Izvelkot trešās pakāpes sakni, iegūst d ≈ 2,28·10-10m. Eksperimentāli noteiktā vērtība ir 1,40 · 10-10 m. Redzams, ka, pieņemot atomus kā apaļas bumbiņas, precīzu rezultātu iegūt nevar, bet vismaz aptuveni apjaust atomu izmēru gan ir iespējams.
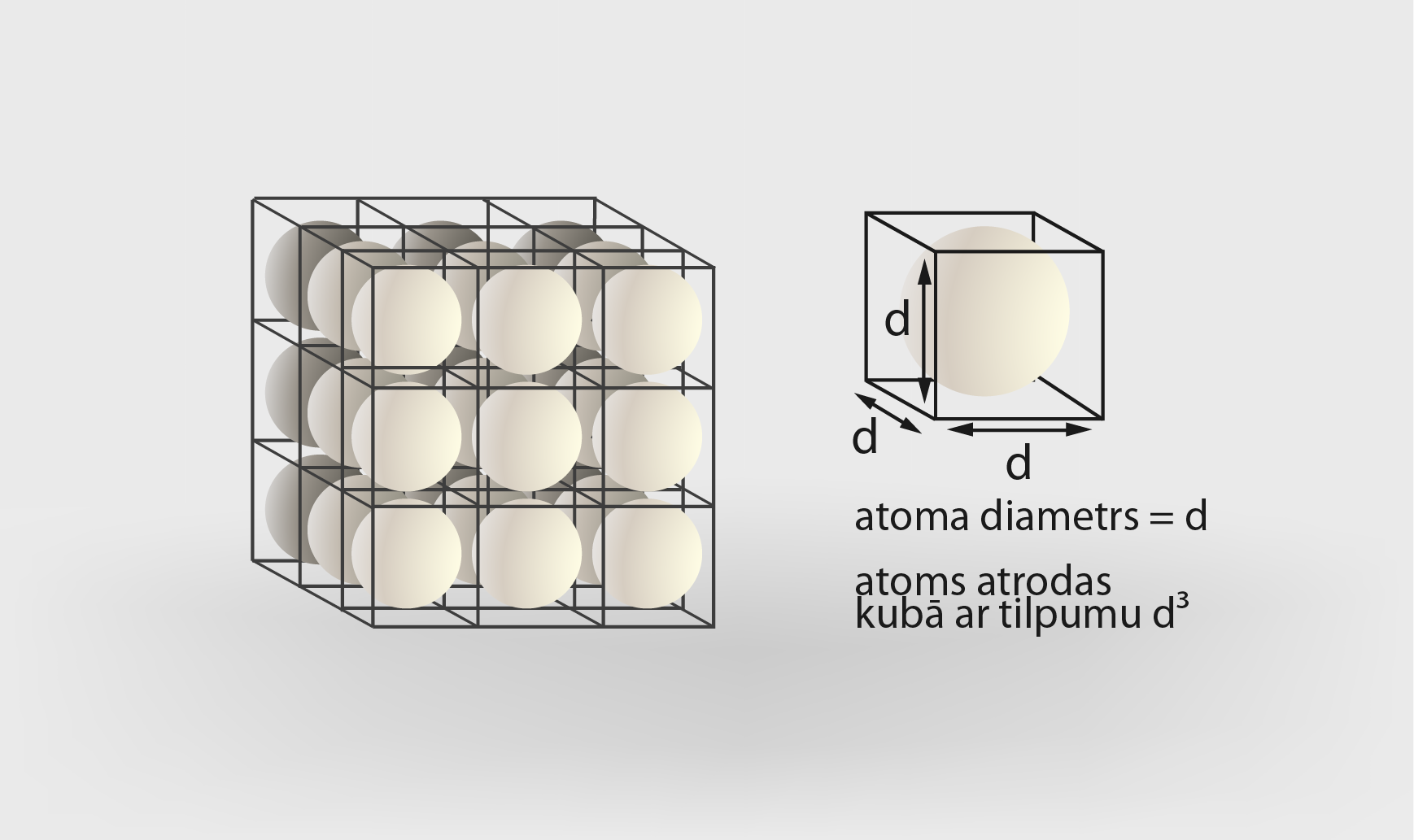
1. att. Dzelzs atoma diametra noteikšana
Lielākajai daļai atomu izmēri ir 1,0 ·1 0-10 m līdz 5,0 · 10-10 m diapazonā. Dažādiem atomiem ir atšķirīgs elektronu skaits, kas atrodas ap kodolu, atšķirīgs ir arī kodola lielums un kodola –elektronu savstarpējā mijiedarbība, tādēļ visiem atomiem nav vienāds izmērs. Dažādu atomu izmēru salīdzinājumu var apskatīt 2. attēlā.
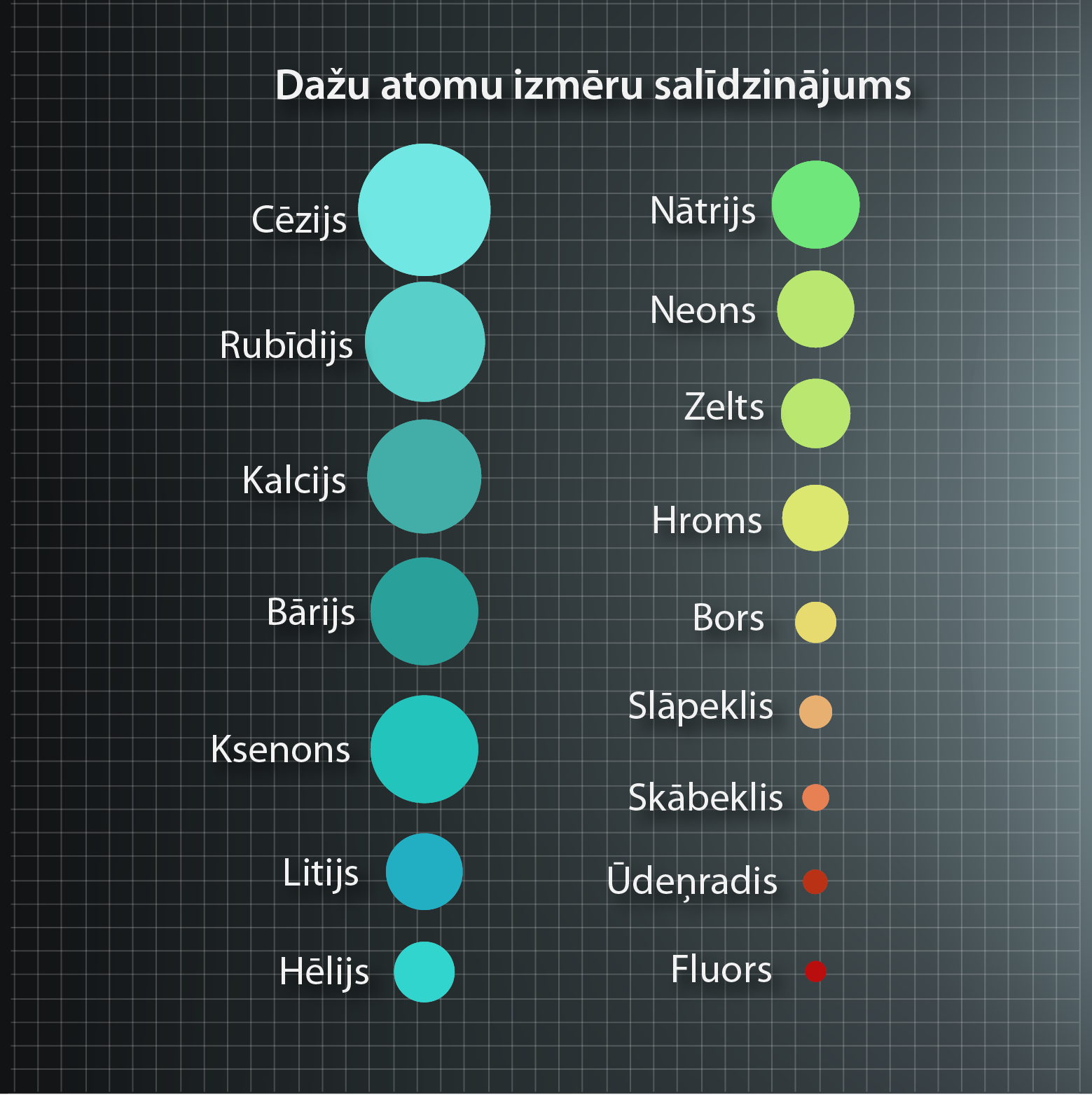
2.att. Atomu izmēru salīdzinājums
Uzskati par atoma uzbūvi ir mainījušies līdzi laikam, pielāgojoties dažādiem atklājumiem, kas skar atoma uzbūvi. 19. gadsimta sākumā Džons Daltons izvirzīja teoriju, ka atomi ir sīkas nedalāmas sfēras (3. att. a), tomēr gandrīz gadsimtu vēlāk Dž. Dž. Tomsons atklāja, ka atomi satur sīkas negatīvi lādētas daļiņas – elektronus. Uz šī atklājuma fona radās atoma modelis, kurā pozitīvas vielas sfērā ir iegremdēti elektroni (3. att. b). Izskata dēļ šis modelis tika nosaukts par “rozīņu pudiņa” modeli.
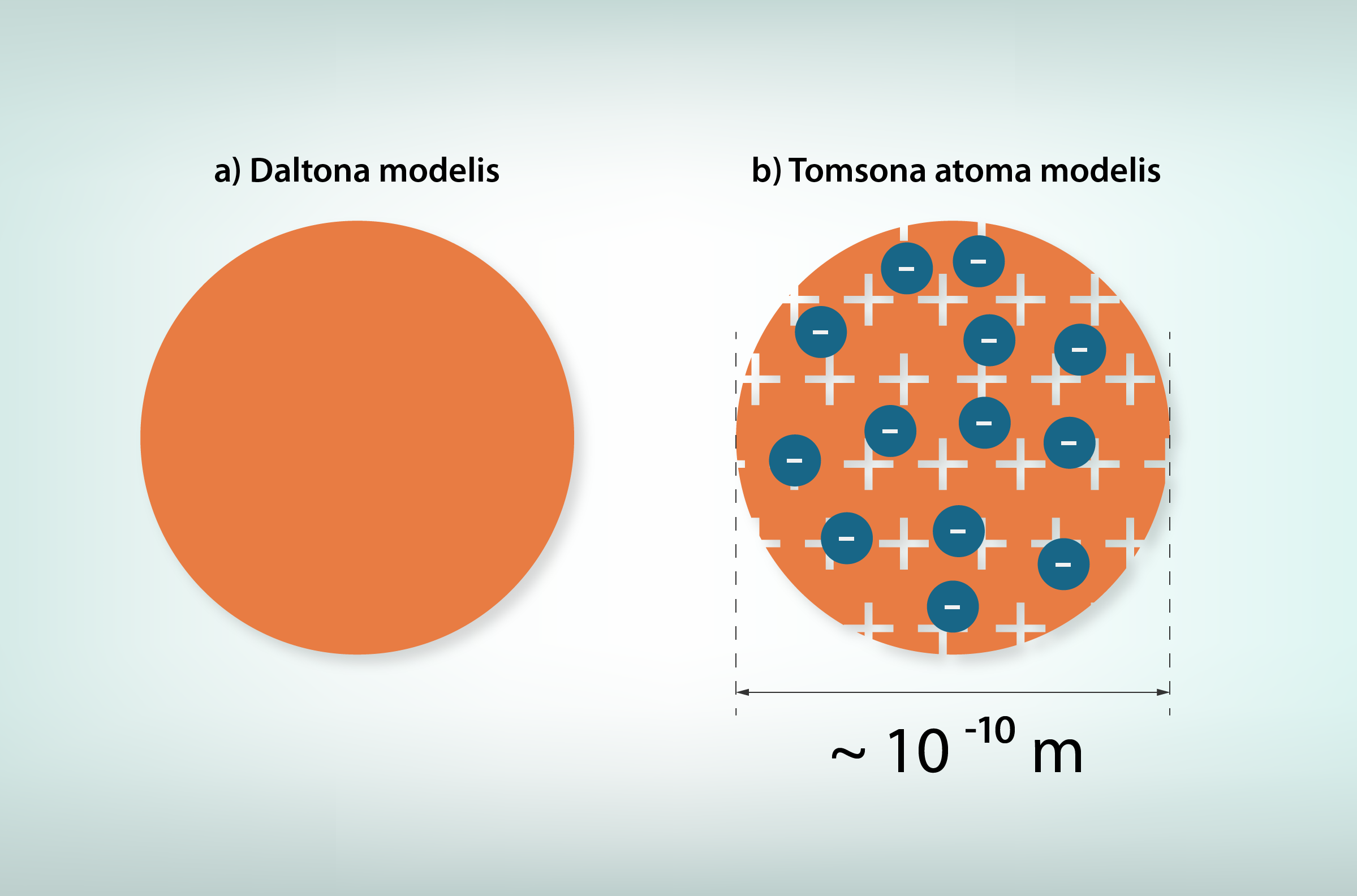
3.att. Daltona un Tomsona atomu modeļi
Trieciens “rozīņu pudiņa” modelim bija angļu fiziķa Ernesta Rezerforda un divu viņa studentu veiktais eksperiments, kurā zelta folija tika apšaudīta ar alfa daļiņām (Hēlija atoma kodoliem). Ja atoms būtu tāds, kā to atveido “rozīņu pudiņa” modelis, tad alfa daļiņām vajadzētu diezgan netraucēti tikt cauri zelta folijai, taču tika novērots, ka daļa no alfa daļiņām stipri noliecas, bet dažās daļiņas tiek atsistas atpakaļ (4. att. a). Situācija ir līdzīga tam, ja mēs ripinātu bumbiņu līdzenumā, kurā ir uzkalns (4. att. b). Ja bumbiņu ripo garām uzkalnam, tad tā nemaina savu taisno kustības trajektoriju, bet, ja bumbiņa trāpa uzkalnā, tās kustības trajektorija var krasi izmainīties. Šis uzkalns atomā izrādījās atoma kodols.
Izmēģini Rezerforda eksperimentu sīklietotnē!
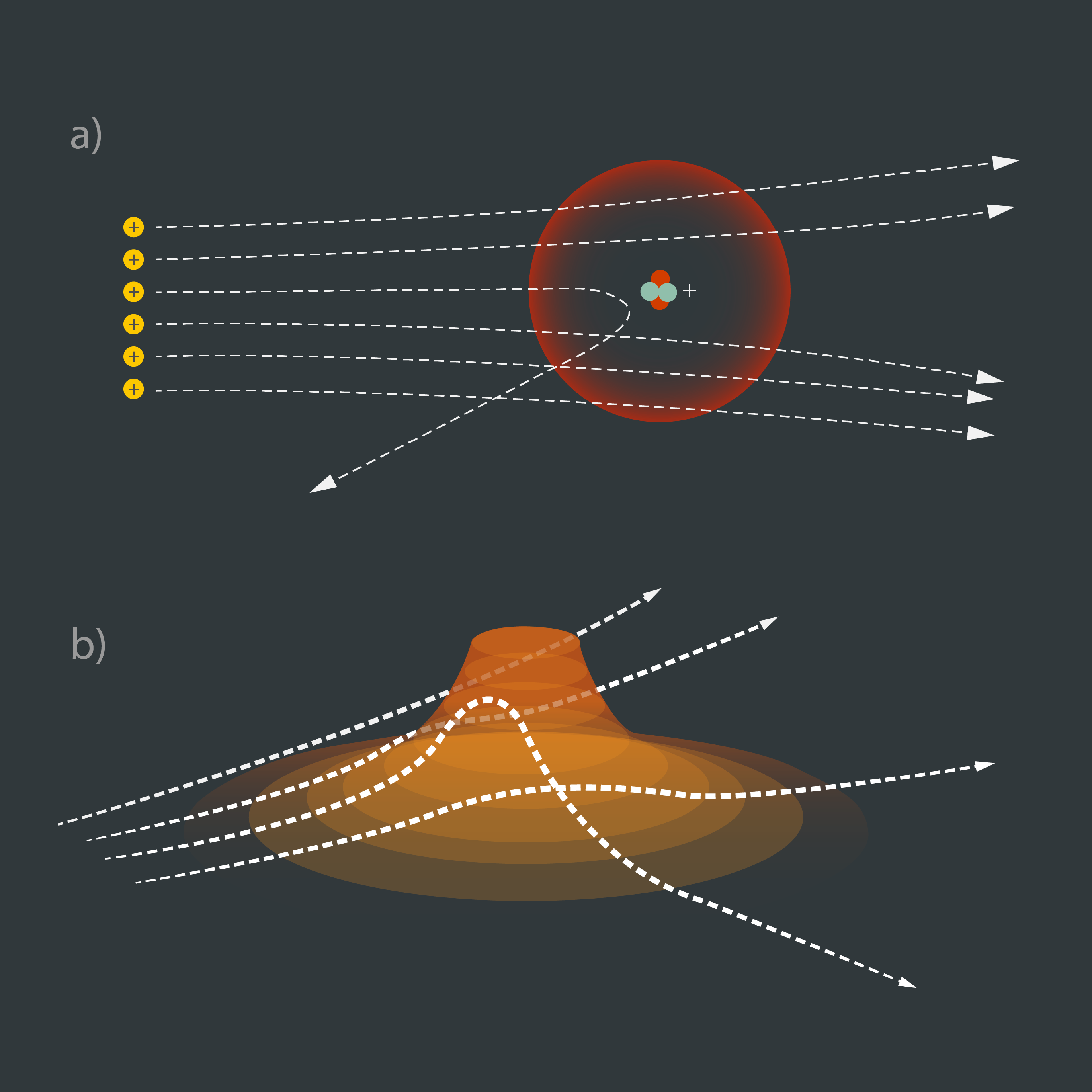
4.att. Atoma kodola atklāšana
Rezerforda eksperimentā tika pieradīts, ka atoma centrā atrodas mazs, smags un pozitīvi lādēts šķērslis alfa daļiņām – atoma kodols. Pēc šī eksperimenta veikšanas radās planetārais atoma modelis, kurā, līdzīgi kā planētas riņķo ap Sauli, elektrons pārvietojas ap pozitīvi lādētu kodolu (5. att. a).
Tomēr ir viena liela atšķirība starp planētu kustību ap Sauli un elektrona kustību ap kodolu, kuras dēļ fizikā bija jāsper lielais solis no klasiskās fizikas un kvantu fiziku. Pēc klasiskās fizikas likumiem elektronam, riņķojot ap kodolu, vajadzētu līdzīgi kā antenai izstarot EM viļņus, tādā veidā zaudējot enerģiju. Ja elektrons zaudētu enerģiju, tad tam pēc kāda laika vajadzētu nokrist uz atoma kodola (5. att. b). Tomēr atoms ir stabila sistēma un šāda elektrona “avarēšana” nenotiek.

5.att. Atoma planetārais modelis
Atoma uzbūves laukā soli kvantu fizikas virzienā pirmais spēra dāņu fiziķis Nilss Bors, kura atoma modelī elektrons var atrasties uz stacionārām (nemainīgām) orbītām un tas “nedrīkst” starot (6. att.). Starošana ir iespējama tikai tajā gadījumā, ja elektrons pāriet no vienas stacionārās orbītas uz citu. Stacionāro orbītu atrašanās vietu nosaka Bora kvantēšanas nosacījums (postulāts). Elektronam, riņķojot ap kodolu, piemīt orbitālais impulsa moments (Dažādi momenti fizikā) L = mevr, kur
me– elektrona masa, kg
v – elektrona ātrums, m/s
r – orbītas rādiuss, m
Pēc Bora kvantēšanās nosacījuma, iespējamas ir tādas orbītas, kurām L = nh : 2π, kur
n = 1, 2, 3 …
h – Planka konstante, J·s
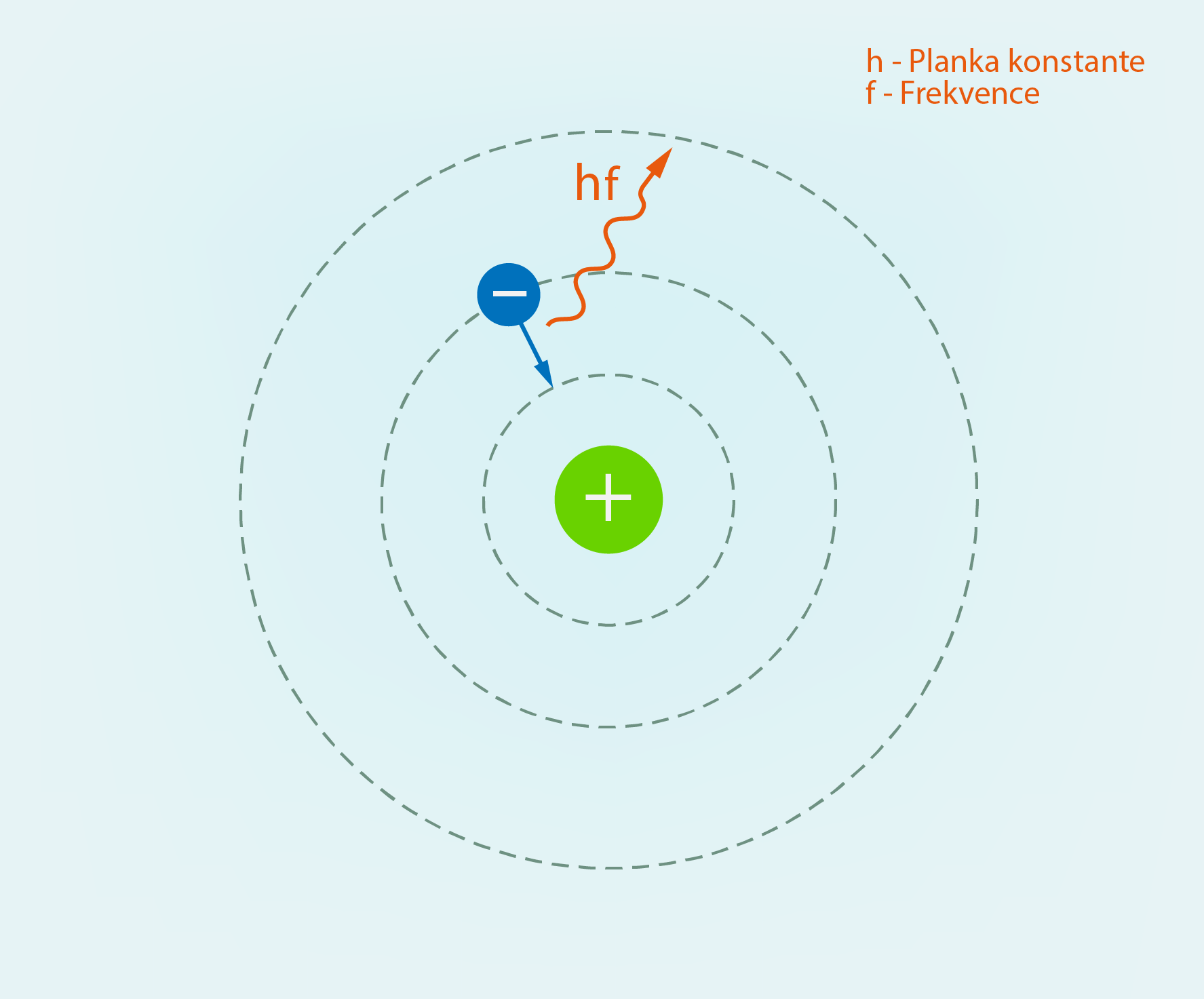
6.att. Bora atoma modelis
Uz katras stacionārās orbītas elektronam ir arī noteikta enerģija E. Kodolam tuvāko orbītu sauc par pamatstāvokli jeb pamatlīmeni, un tā enerģija ir E1. Visu pārējo orbītu enerģijas E2, E3… ir lielākas par E1, jo tās atrodas tālāk no kodola. 7. attēlā redzams, ka pie lielākiem orbītas rādiusiem tajos esošo elektronu enerģijas skaitliski kļūst arvien tuvākas cita citai.
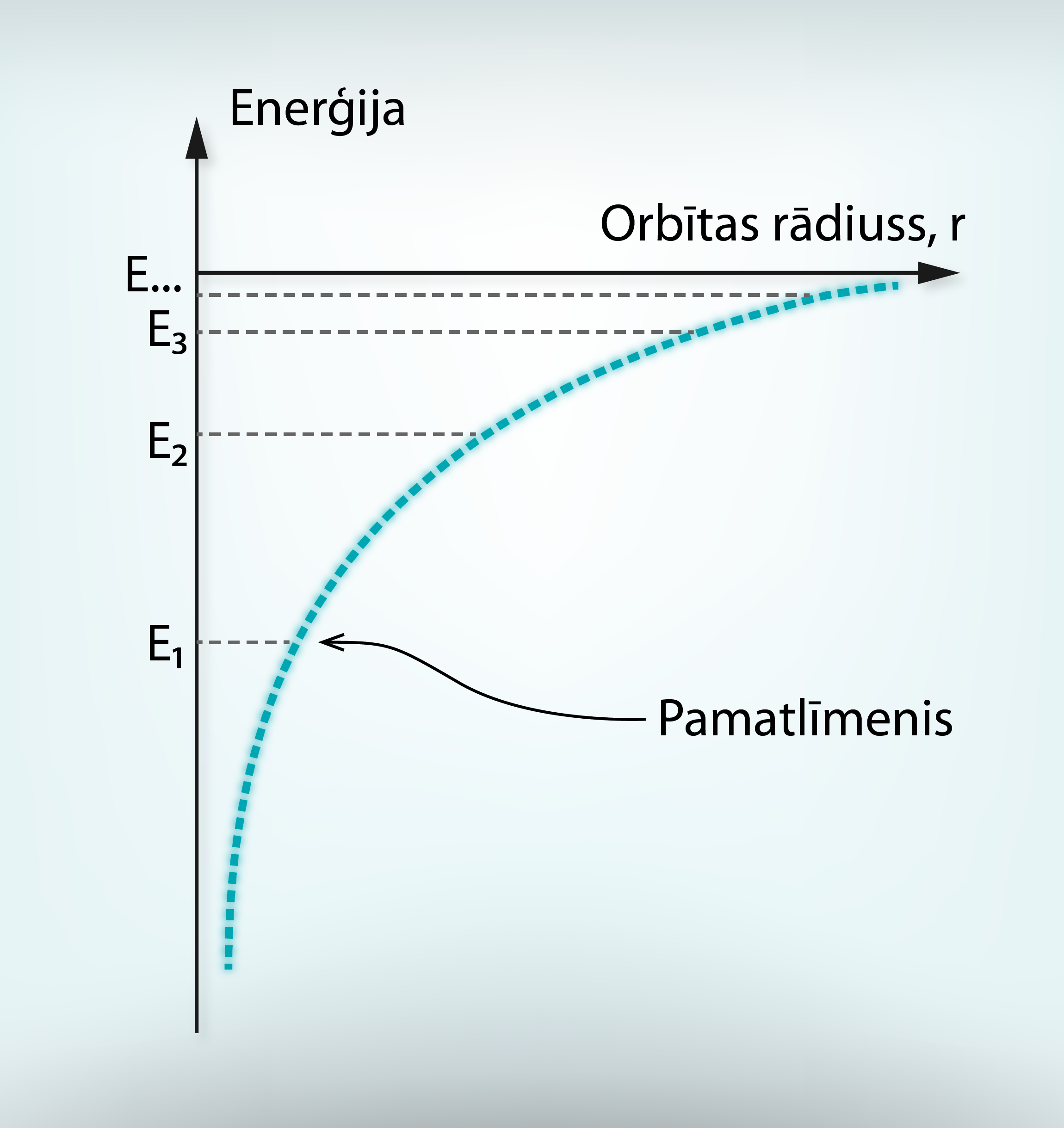
7.att. Elektrona enerģija dažādās orbītās
Ja elektronu uzskata par bumbiņu, kas kustas ap kodolu, tad nav iespējams izskaidrot tā diskrētās (pārtrauktās) kustības orbītas. Tādēļ bija jāmeklē citāds elektronu kustības skaidrojums. Franču fiziķis Luijs Viktors de Broljī salīdzināja elektronu kustību ar stāvviļņu veidošanos stīgā (1. att. a). Piemēram, ģitāras stīgā var veidoties stāvviļņi (muzikālās skaņas) ar tādu viļņu garumu, ka stīgas garumā iekļaujas vesels skaits pusviļņu garumu. Līdzīgi ir arī atoma gadījumā: ap kodolu var pastāvēt tādi viļņi, kuriem orbītas garumā 2πr, kur r – orbītas rādiuss, iekļaujas vesels skaits pusviļņu garumu (1. att. b).
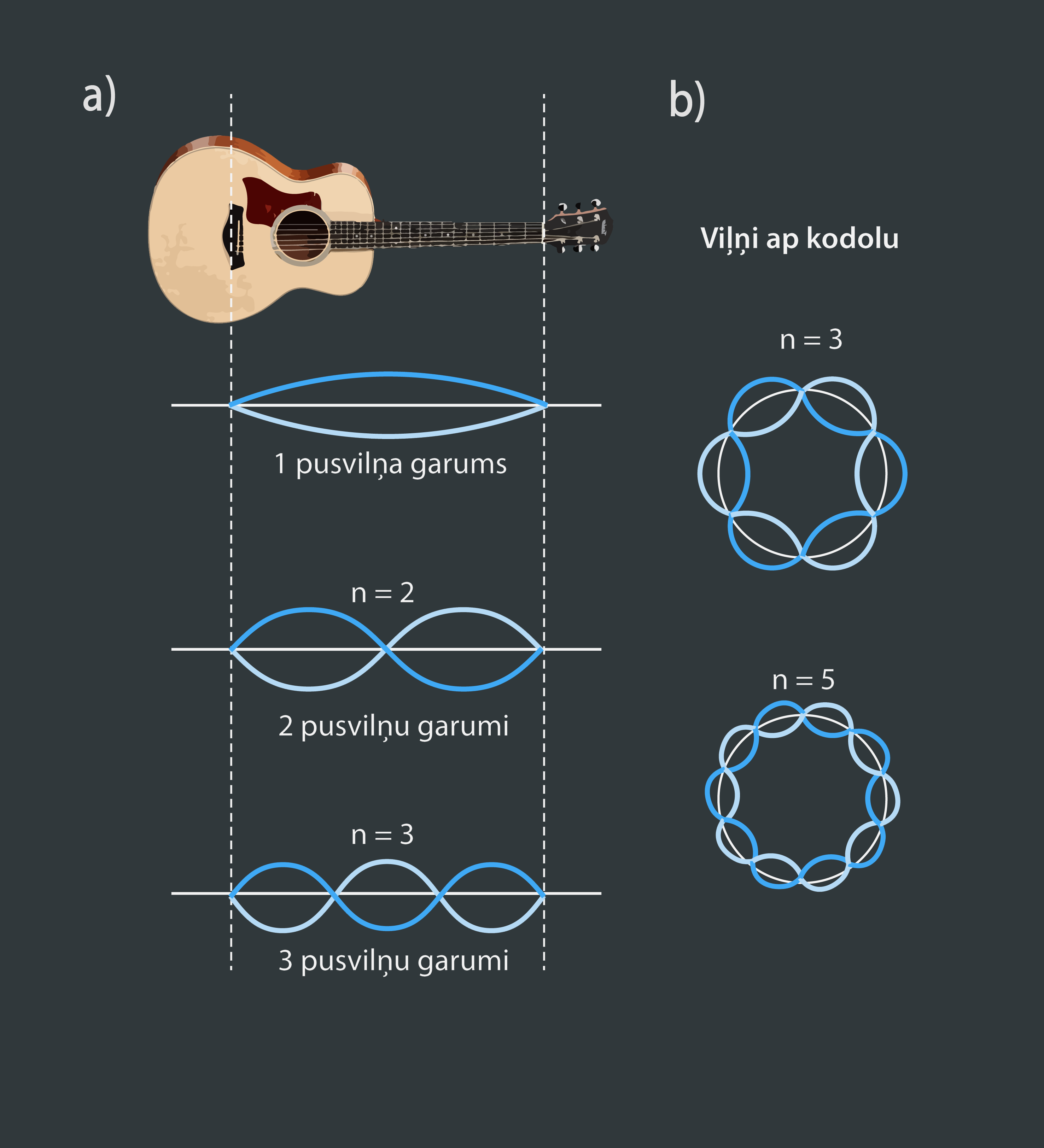
1.att. Elektroni kā stāvviļņi ap kodolu
Ja stacionāro orbītu veidošanās tiek skaidrota ar stāvviļņu veidošanos, tad elektronam ir jākustas kā vilnim. Līdz šim elektronu uzskatījām par kustībā esošu daļiņu, un ar to pilnībā pietika, lai izskaidrotu, piemēram, strāvas plūsmu vadā (Elektriskās strāvas stiprums). Tomēr izrādās, ka katrai kustībā esošai daļiņai piemīt arī viļņa kustības īpašības (2. att.), turklāt tāda viļņa, kura viļņa garums λD = h : (mv), kur
h – Planka konstante, J·s
m – daļiņas masa, kg
v – daļiņas ātrums, m/s
Šo viļņu garumu sauc par De Broljī viļņa garumu. Izklausās dīvaini, bet arī kustībā esošam cilvēkam var aprēķināt viļņu garumu. Pieņemsim, ka 80 kg smags cilvēks pārvietojas ar ātrumu 2 m/s. Ieliekot vērtības formulā, iegūst λD = 6,62 · 10-34 : (80·2) ≈ 4,14 ·10-36.Tas ir tik mazs viļņu garums, salīdzinot ar apkārtējo ķermeņu izmēriem, ka cilvēka kustībā viļņu īpašības nevar novērot. Ar elektronu ir citādāk, jo tam ir lielāks ātrums un mazāka masa, tādēļ elektrona De Broljī viļņa garums ir salīdzināms ar atoma izmēriem (≈10-10m). Šī iemesla dēļ elektrona kustībā ap atomu tam izpaužas viļņu īpašības.
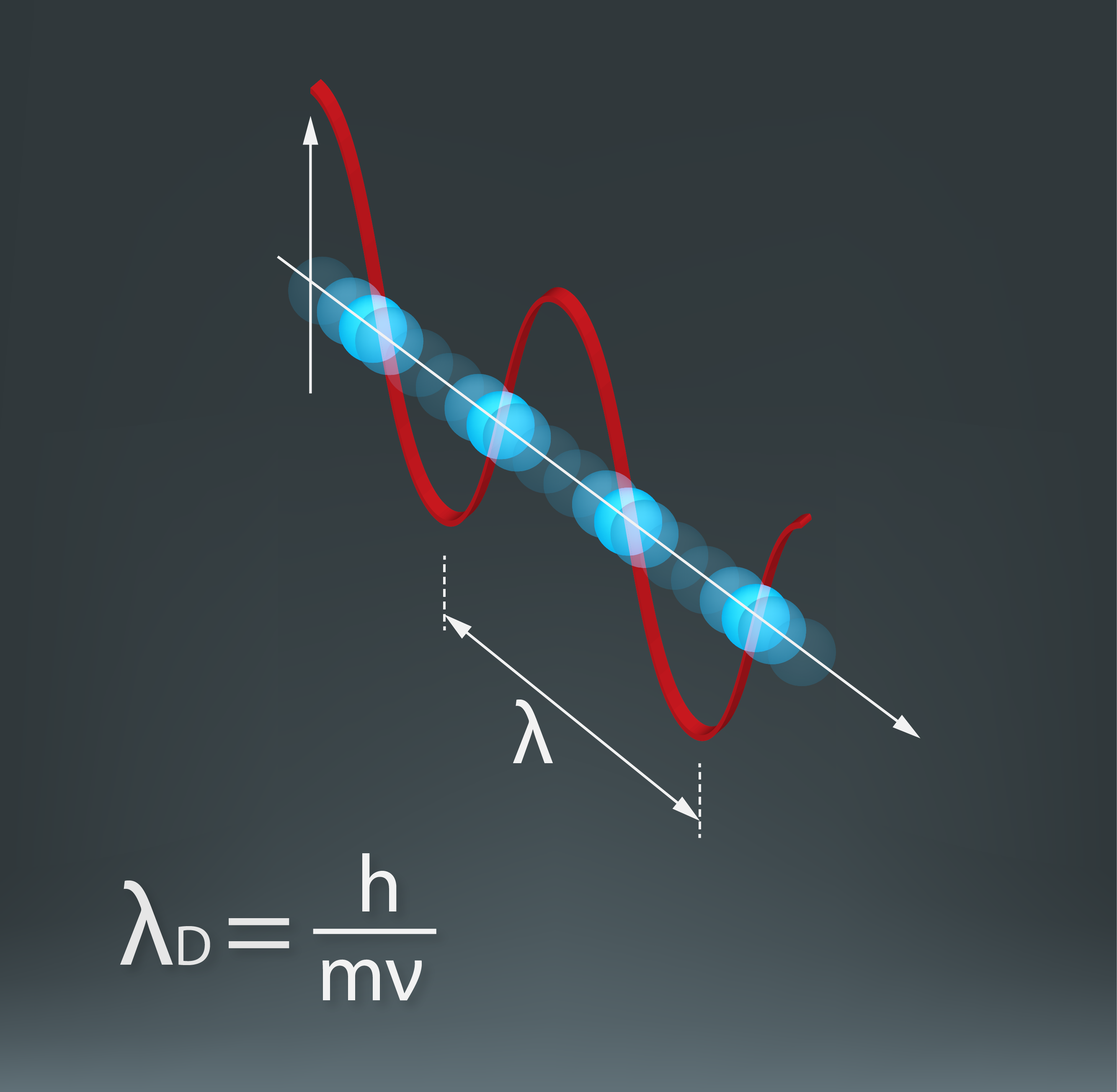
2.att. De Broljī viļņi
Ņemot vērā De Broljī viļņu ideju, pretstatā Bora atoma riņķveida elektronu orbītām (3. att. a) De Broljī atoma modelī katra orbīta tiek attēlota ar tajā ietilpstošajiem stāvviļniem (3. att. b).
Apskaties sīklietotni par Bora un De Broljī atoma modeļiem!
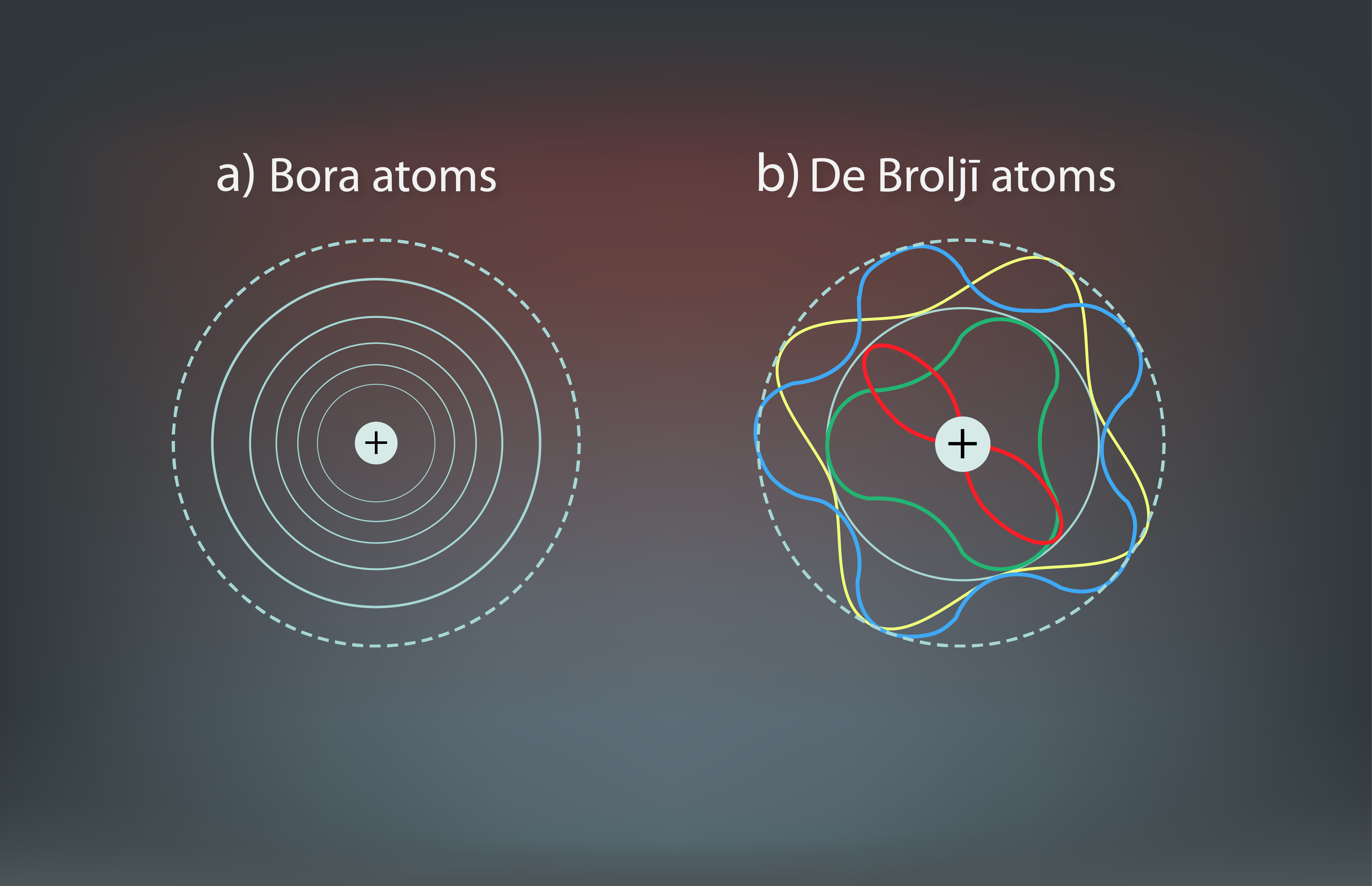
3.att. Bora un De Broljī atoma modeļi
Ja elektrons izplatās kā vilnis, tad tam nav noteiktas kustības trajektorijas, līdz ar to nav iespējams pateikt, kur precīzi elektrons atrodas. Tādēļ lieto jēdzienu elektrona mākonis. Šo mākoni var uzskatīt par elektronu, kas ir izpludināts telpā ap kodolu (4. att.). Dažās telpas daļās tas var būt, dažās – plānāks. Vietās, kur šis mākonis ir biezāks, elektronu sastapt ir lielāka varbūtība nekā tur, kur tas ir plānāks. Šādā gadījumā elektrona kustības orbitāle vairs nav šaura līnija – par elektrona orbitāli uzskata to telpas daļu, kurā varbūtība sastapt elektronu ir vienāda ar 90 %.

4.att. Elektronu mākonis ap kodolu
Elektronu orbitālēm var būt visdažādākās formas, sākot no vienkāršas sfēras līdz pat ļoti sarežģītu telpisku figūru apvienojumam (5. att.).
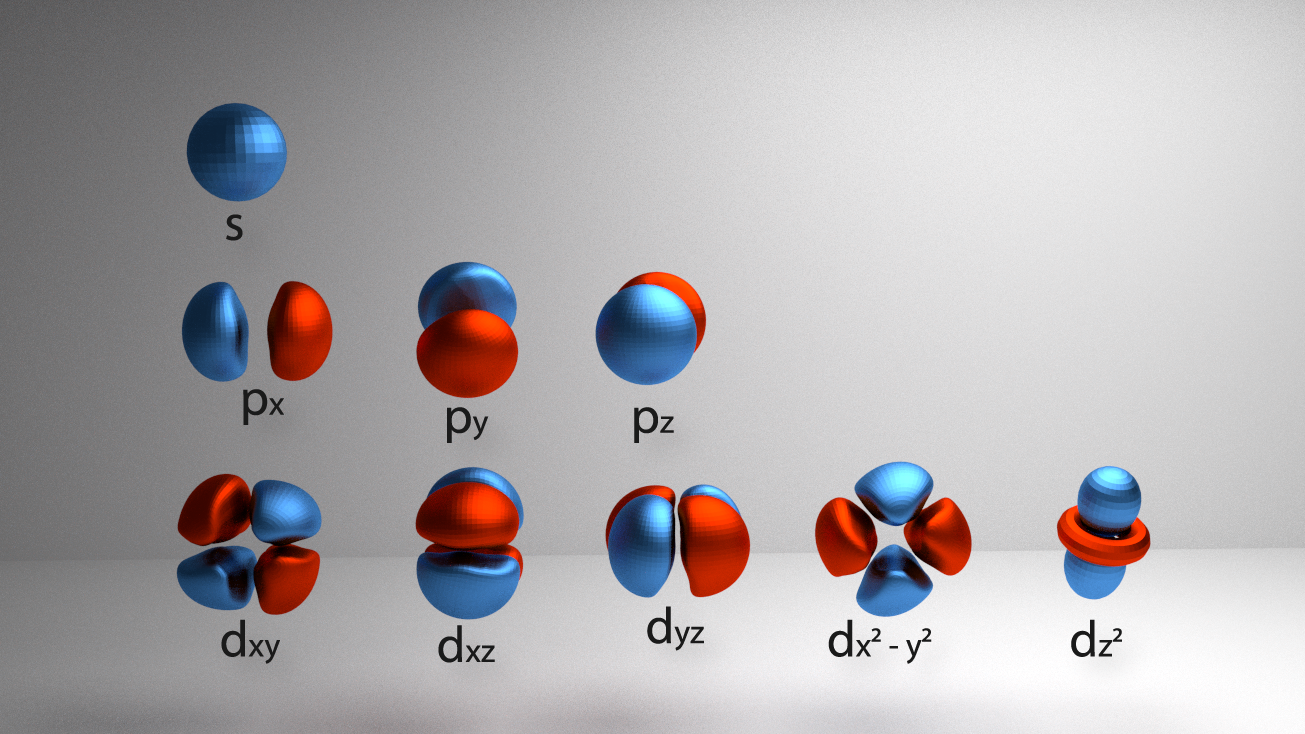
5.att. Dažādas elektronu orbitāles
Ja divi atomi nonāk viens otram tuvumā, tad tie sāk savstarpēji mijiedarboties. To var izmantot, lai izveidotu augstas precizitātes mikroskopu, sauktu par atomspēku mikroskopu. Pētot paraugu ar šo mikroskopu, tā virsma tiek skenēta ar adatu un tiek reģistrēts mijiedarbības spēks starp adatu un virsmu. Tādā veidā var iegūt parauga virsmas attēlus (6. att.), kuru izšķirtspēja sasniedz atoma izmērus. Tas nozīmē, ka parauga virsmā var saskatīt atsevišķus atomus.
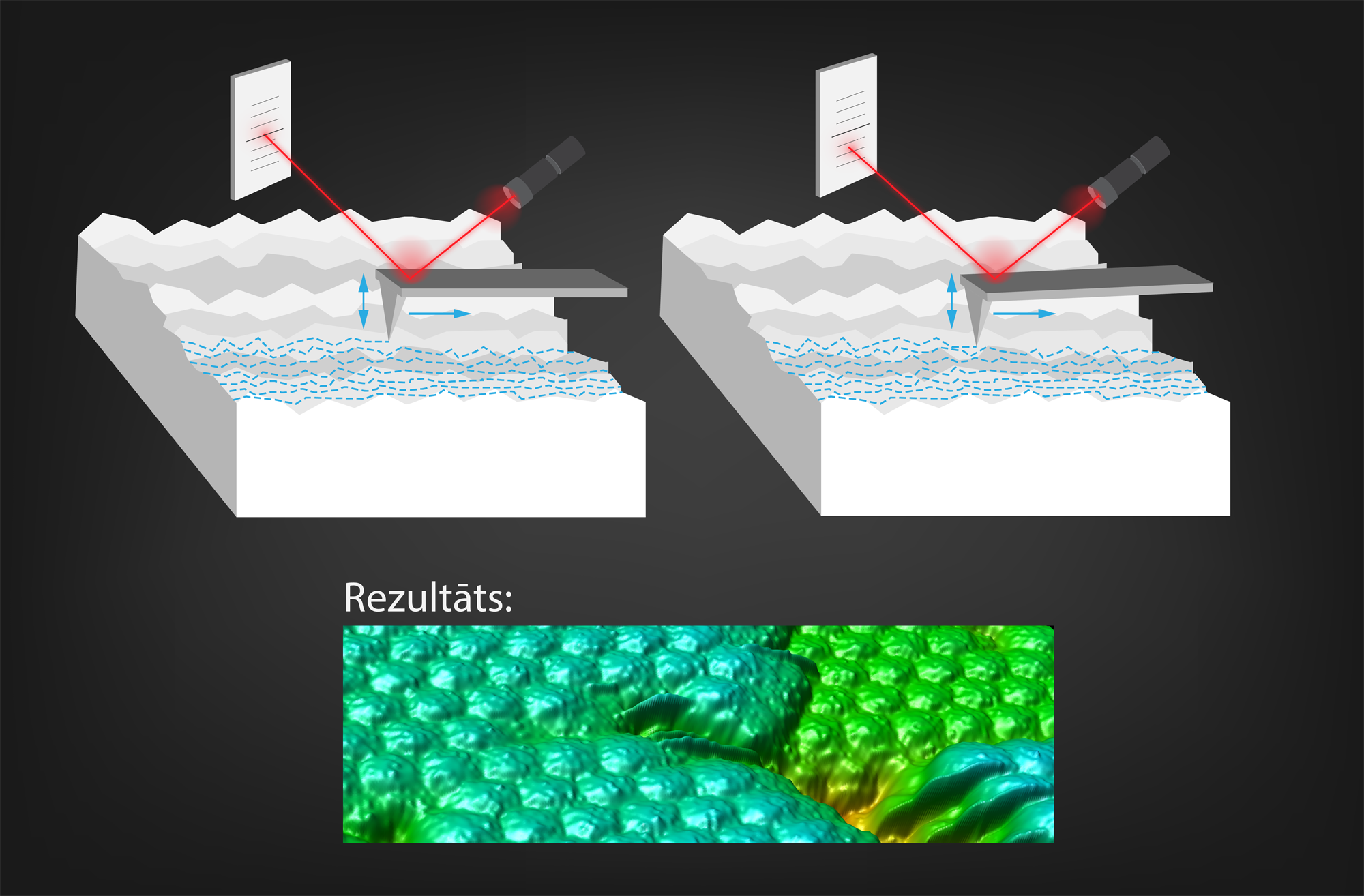
6.att. Ar atomspēku mikroskopu iegūts attēls
Lai gan atomi ir ļoti maziņi, firma IBM ir paguvusi izveidot multiplikācijas filmu, kurā katrs kadrs ir veidots, izmantojot atomus.