Atoma kodols tika pieminēts jau sadaļā par atoma uzbūvi. Kodola izmērs (aptuveni 10-14m) ir niecīgs, salīdzinot ar visa atoma izmēru (aptuveni 10-10m) (1. att. a), tomēr kodolā ir koncentrēta faktiski visa atoma masa. Tas ir tādēļ, ka kodolu veido nukloni – protoni un neitroni –, kas ir daudz smagāki par elektroniem (1. att. b). Protona un neitrona masa ir aptuveni līdzīga ar nelielu pārsvaru neitrona pusē. Izsakot atoma masu vienībās (Vielas uzbūve, molekulu siltumkustība), protona masa ir 1,0073 u, bet neitrona – 1,0087 u. Salīdzinoši elektronam masa atommasas vienībās ir tikai 0,0006. Lai nodrošinātu atoma elektrisko neitralitāti, kodolam jābūt pozitīvi lādētam. Pozitīvo kodola lādiņu nodrošina protoni, kam pēc lieluma ir tāds pats lādiņš kā elektronam, tikai ar pretējo zīmi (1. att. c). Neitrons ir daļiņa bez lādiņa. Neitroniem lādiņš nepiemīt, tādēļ to skaits neitrāla atoma var būt dažāds.
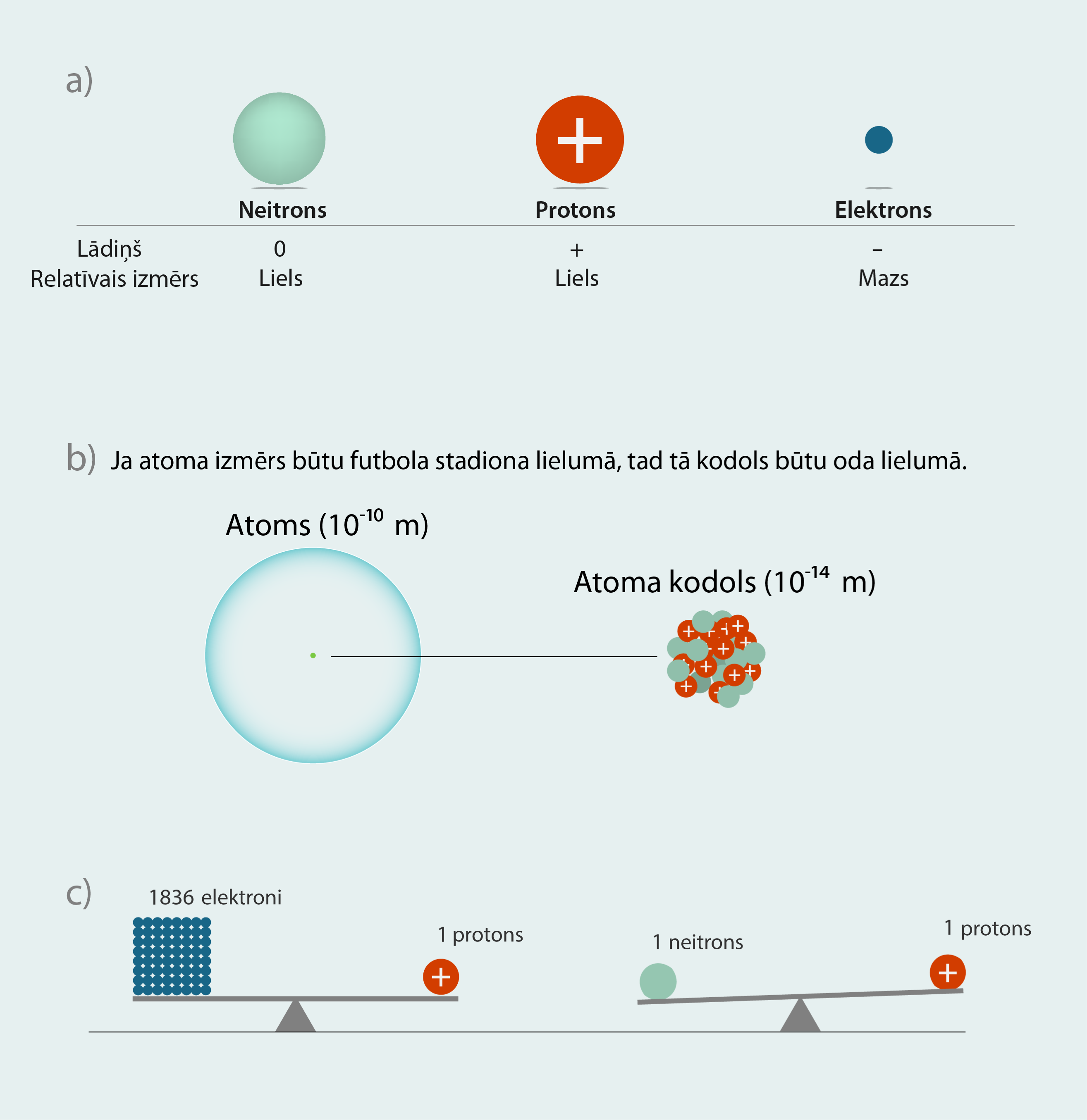
1.att. Kodols kā atoma uzbūves elements
Atoma kodols tika atklāts, apšaudot zelta foliju ar alfa daļiņām un konstatējot, ka dažas alfa daļiņas tiek stipri noliektas un pat atsistas gandrīz pilnībā atpakaļ (Atoma uzbūve); tas liecina par mazu, bet masīvu objektu atoma centrā, kas vēlāk izrādījās atoma kodols. Tikai vēlāk noskaidrojās, ka alfa daļiņas patiesībā ir hēlija atoma kodoli, kas sastāv no diviem protoniem un diviem neitroniem (2. att. a). Hēlijs ķīmisko elementu periodiskajā tabulā atrodas pašā sākumā, tādēļ tā kodolā nav liels nuklonu skaits, taču, pieaugot elementa kārtas skaitlim, nuklonu skaits pakāpeniski pieaug. Tādēļ attēlot, piemēram, urāna kodolu ir daudz grūtāk, jo tajā ir vairāk nekā 200 nuklonu (2. att.).
Aplūko vēl vienu materiālu par atoma kodola uzbūvi!
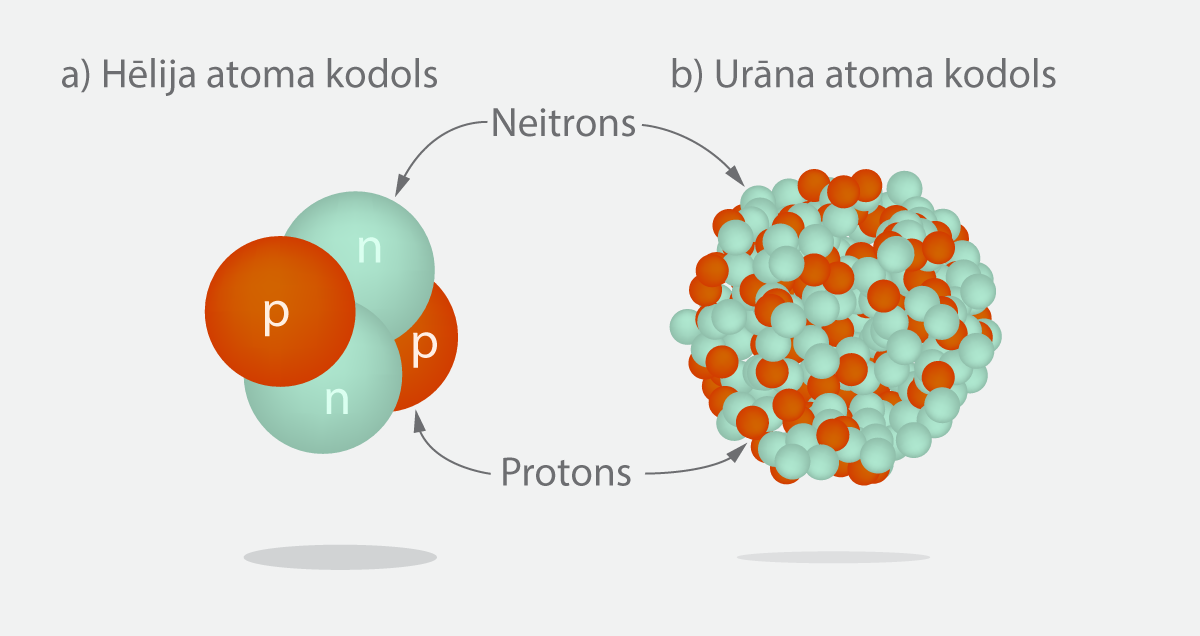
2.att. Hēlija un urāna kodoli
Divi nozīmīgi lielumi, kas raksturo atoma kodolu, ir atomnumurs Z, kas ir vienāds ar protonu skaitu kodolā, kā arī kodolā esošo neitronu skaits N. Kopējo nuklonu skaitu apzīmē ar A=Z+N. Atoma kodolu apzīmēšanai izmanto ķīmiskā elementa simbolu, kuram kreisajā augšējā stūrī norāda nuklonu skaitu A, bet kreisajā apakšējā stūrī protonu skaitu jeb atomnumuru (3. att. a). Neitronu skaitu kodolā iespējams aprēķināt, no nuklonu skaita atņemot protonu skaitu. Piemēram, urāna23592U kodolā ir 92 protoni un 235 – 92 = 143 neitroni (3. att. b).
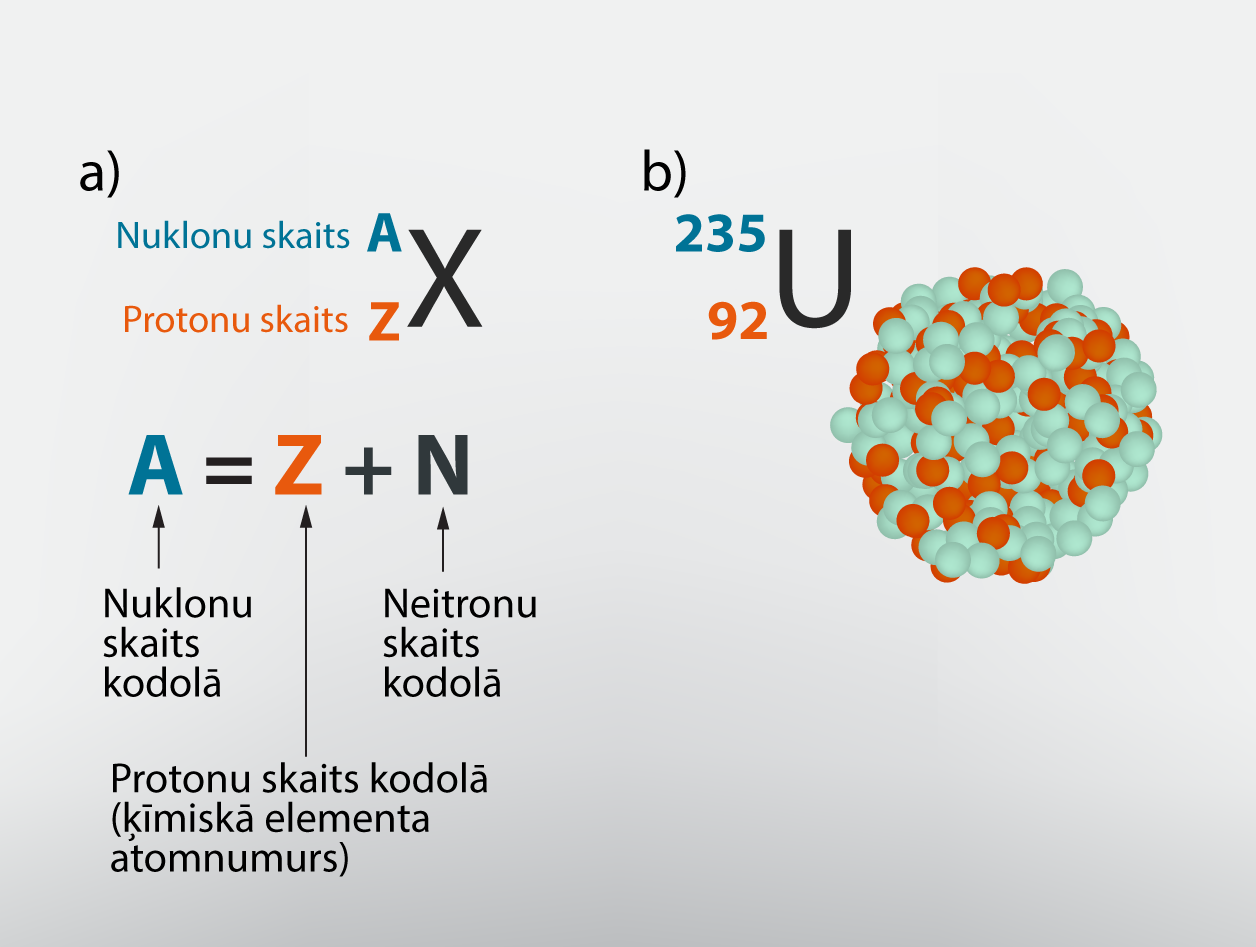
3.att. Atomu kodolu apzīmēšana
Atoma uzbūve nedaudz atgādina lego klucīšus (4. att. a): atoms ir izveidots no divu veidu klucīšiem – protoniem un neitroniem (4. att. b, c). Ja paņem 6 protonus un 8 neitronus, tad izveidojas oglekļa kodols ar 14 nukloniem (4. att. b), bet, ja paņem 1 protonu un 2 neitronus, tad izveidojas ūdeņraža kodols ar 3 nukloniem (4. att. c). Svarīgi ir tas, ka elementa veidu nosaka protonu skaits kodolā, tādēļ, tiklīdz kodolam atņem vai pievieno kādu protonu, uzreiz mainās ķīmiskais elements.
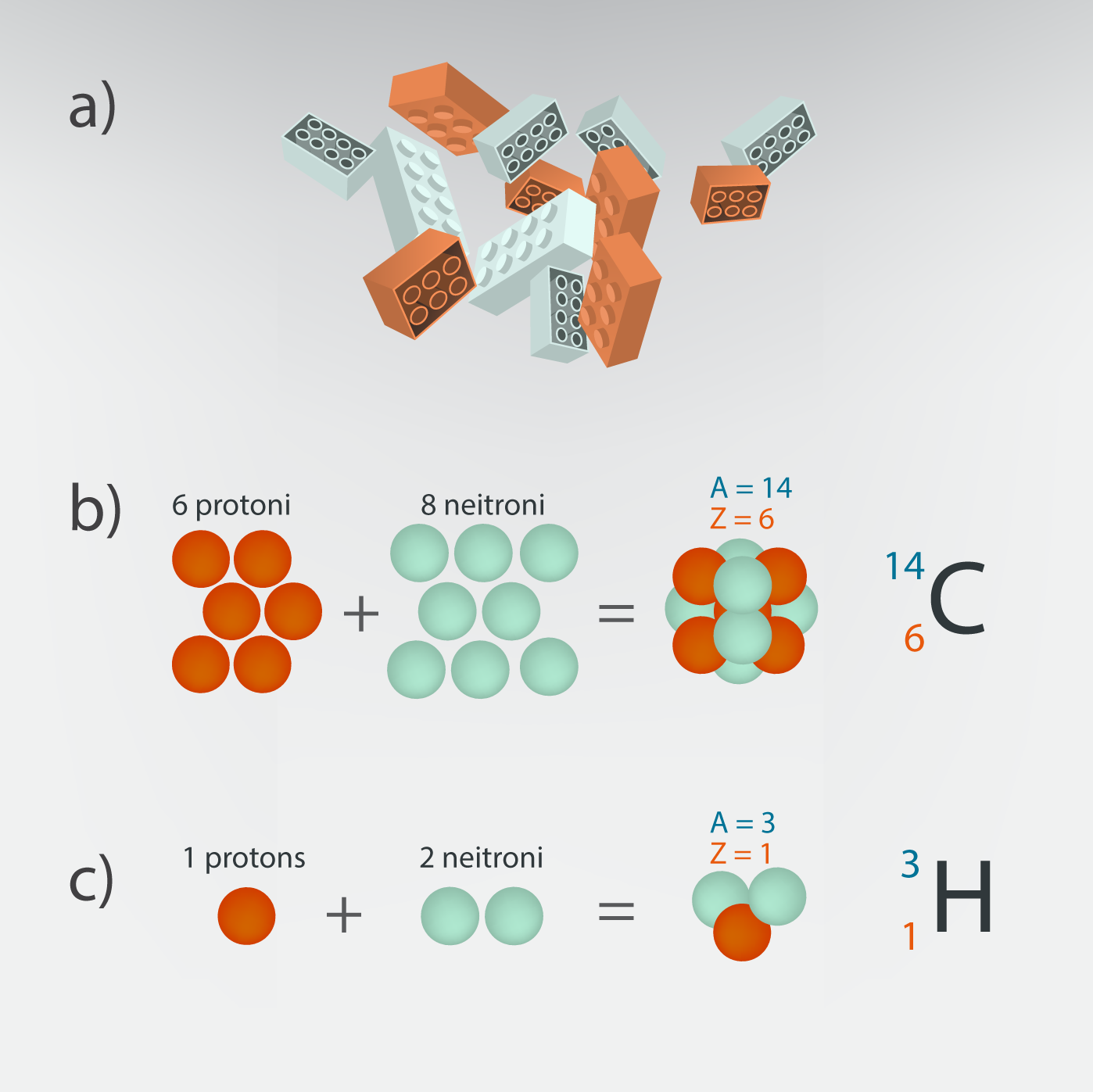
4.att. Dažādu kodolu sastāvs
Mainot neitronu skaitu kodolā, elementa veids nemainās, bet izmaiņas kodolā notiek. Ķīmiskā elementa atomus, kuriem sakrīt kodolā esošo protonu skaits, bet atšķiras neitronu skaits, sauc par izotopiem. Piemēram, ūdeņradim ir zināmi trīs izotopi. Visizplatītākais ir ūdeņradis, kuram kodols sastāv tikai no viena protona (5. att. a). Otrs dabā sastopamais izotops ir deitērijs (5. att. b), kuram kodolā ir papildus viens neitrons. Dabā nesastopams, bet laboratorijā iegūts ir trešais ūdeņraža izotops tritijs, kuram kodols sastāv no viena protona un diviem neitroniem (5. att. c). Dažādi izotopi ķīmiskajās reakcijās uzvedas vienādi, jo elektronu apvalki neatšķiras, tādēļ tie ķīmisko elementu periodiskajā tabulā atrodas vienā lodziņā. Dažādu izotopu atšķirības izpaužas kodolreakcijās.
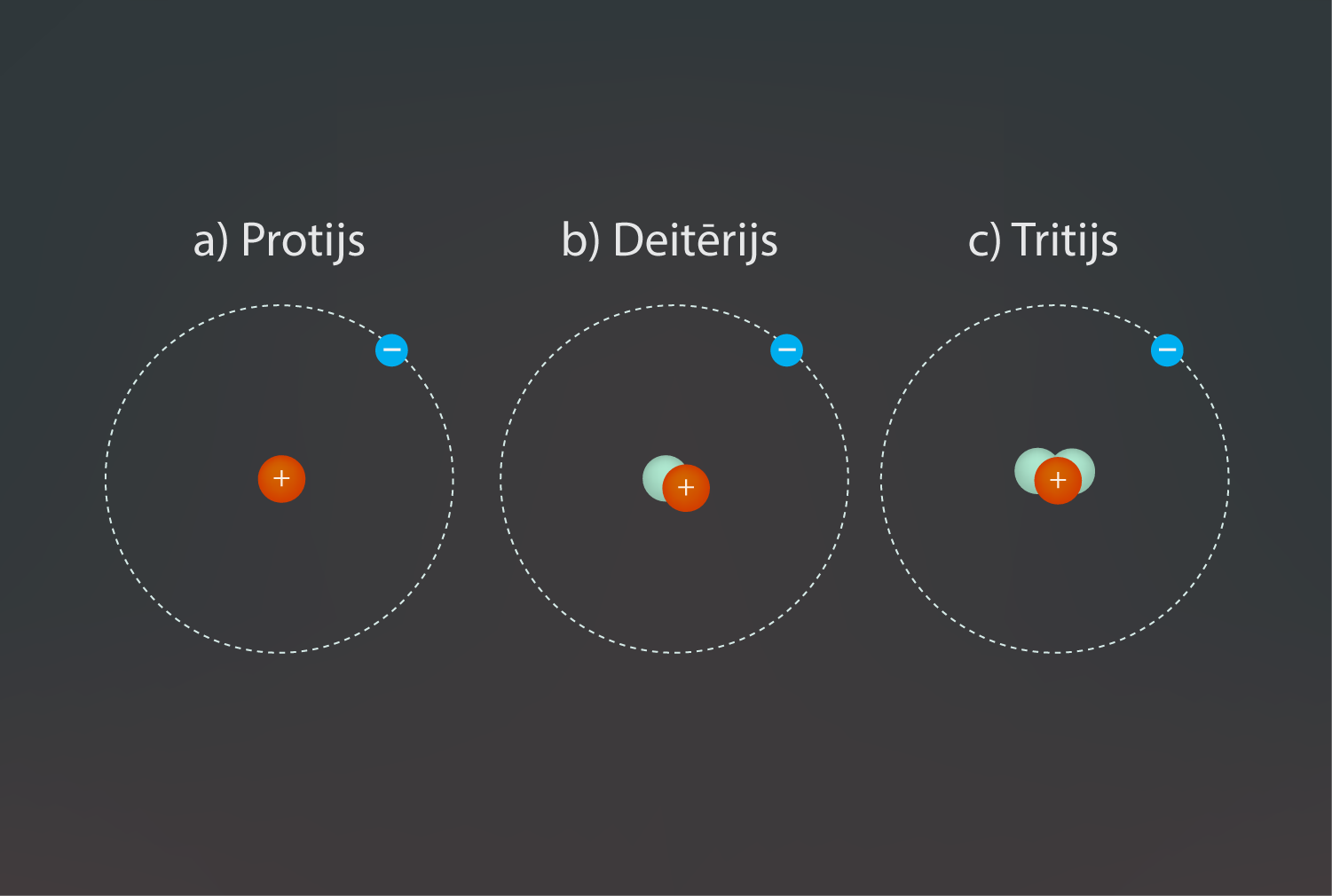
5.att. Dažādi ūdeņraža izotopi
Lai gan iepriekš tika minēts, ka kodola izmērs ir aptuveni 10-14m, tomēr dažādu atomu kodoliem izmēri atšķiras, jo atšķirīgs ir to veidojošo nuklonu skaits. Ūdeņradis ir pavisam nabadzīgs, jo tam kodolā ir tikai viens nuklons un līdz ar to no atomu kodoliem tam ir vismazākais rādiuss, kas vienāds ar 1,2 fm (femtometrs; 1 fm = 10-15m). Salīdzinoši 238 urānam (238U) nuklonu jau ir veseli 238 un līdz ar to kodola rādiuss 7,4 fm ir vairāk nekā 6 reizes lielāks. Dažādu atomu kodolu izmēru salīdzinājumu var apskatīt 1. attēlā.
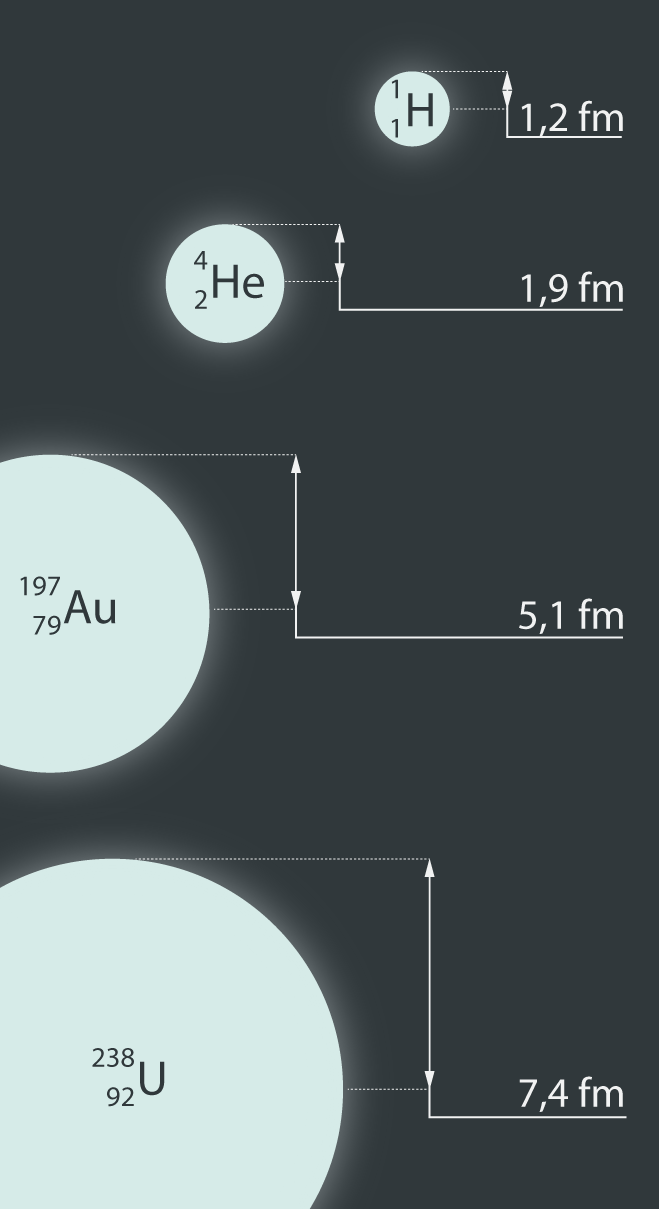
1.att. Dažādu atomu kodolu izmēri
Pieņemot, ka nukloni ir lodītes ar rādiusu r0, varam iegūt tuvinātu izteiksmi kodola rādiusa aprēķināšanai atkarībā no nuklonu skaita. Ja lodveida nuklona rādiuss ir r0 (2. att.), tad tā tilpumu v aprēķina, izmantojot lodes tilpuma formulu v = 4 : 3πr03. Ja kodolā ir A nukloni, tad kopējais kodola tilpums Vir aptuveni V = A · v = A · 4 : 3 πr03, pieņemot, ka nukloni atrodas ļoti cieši cits pie cita. Arī kodolam ir lodveida forma, un tā rādiuss ir r(2. att.). Lietojot kodolam lodes tilpuma aprēķināšanas formulu, V = 4 : 3 πr3. Tā kā kodola un Anuklonu tilpumam ir jābūt aptuveni vienādiem, tad pielīdzinām šos tilpumus 4 : 3 πr3 = A · 4 : 3 πr03. Saīsinot iegūst r3 = Ar03. No šī rezultāta izvelkot kubsakni, iegūst r = r0A1/3. Viena nuklona rādiuss r0ir eksperimentāli atrasta vērtība: r0 = 1,2 · 10-15m. Izmantojot iegūto rādiusa aprēķināšanas izteiksmi 238U, iegūst 7,4 fm – tieši tādu pašu rezultātu, kāds redzams 1. attēlā.
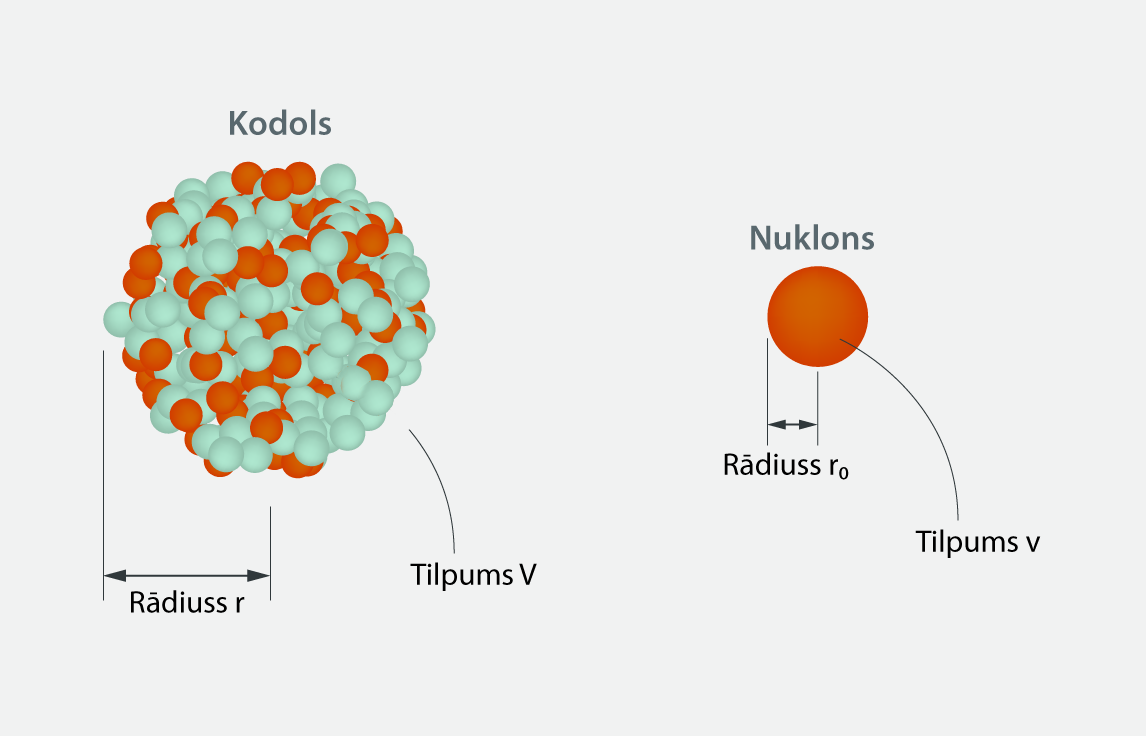
2.att. Kodola un nuklona parametri
Zinot protona un neitrona masu, var novērtēt kodola blīvumu. Protonam un neitronam ir gandrīz vienāda masas, tādēļ pieņemsim, ka visiem nukloniem ir vienāda masa m un tilpums v. Blīvumu ρ aprēķina ρ = m : V, kur
m – nuklona masa, kg
v – nuklona tilpums, m3
Kodola blīvums ρ = Am : Av, kur A – nuklonu skaits kodolā, kas saucējā un skaitītājā saīsinās. Līdz ar to iegūstam, ka visiem kodoliem ir vienāds blīvums m : v. Viena protona masa ir 1,007u, bet neitronam 1,009 u. Vienkāršības labad pieņemsim, ka nuklona masa ir viena atommasas vienība u ≈ 1,66 · 10-27kg. Nuklona tilpuma izteiksmi aizņemoties no kodola rādiusa aprēķiniem (1. att.), iegūstam, ka kodola blīvums ρ = m : v = u : (4 : 3πr03) = (3u) : (4πr03) = (3 · 1,66 · 10-27) : (4 · 3,14 · (1,2 · 10-25)3) = (4,98 · 10-27) : (21,7 · 10-45) ≈ 2,3 · 1017kg/m3. Šis blīvums ir tik iespaidīgs, ka, ja eiro centa monētai būtu šāds blīvums, tā svērtu aptuveni 80 miljonu tonnu.

3.att. Eiro centa masa, ja tā blīvums būtu vienāds ar kodola blīvumu
Atoma kodols ir ļoti blīvs, un, lai šo blīvumu nodrošinātu, nukloniem jāturas cieši kopā citam pie cita. Tas nozīmē, ka nukloni savā starpā ir spēcīgi sasaistīti. Lai šādu cieši sasaistītu kodolu sadalītu, ir nepieciešama liela enerģija. Kodolu var raksturot ar saites enerģiju, kas ir vienāda ar kodola sadalīšanai nepieciešamo enerģiju. Saites enerģija dod informāciju par to, cik stabils ir kodols. Ja grafikā atliek dažādu atomu kodolu saites enerģiju uz vienu nuklonu, tad iegūst 4. attēlā redzamo ainu. Pieaugot saites enerģijas apjomam uz vienu noklonu, pieaug arī kodola stabilitāte. 4. attēlā redzams, ka visstabilākais kodols ir dzelzij (Fe).
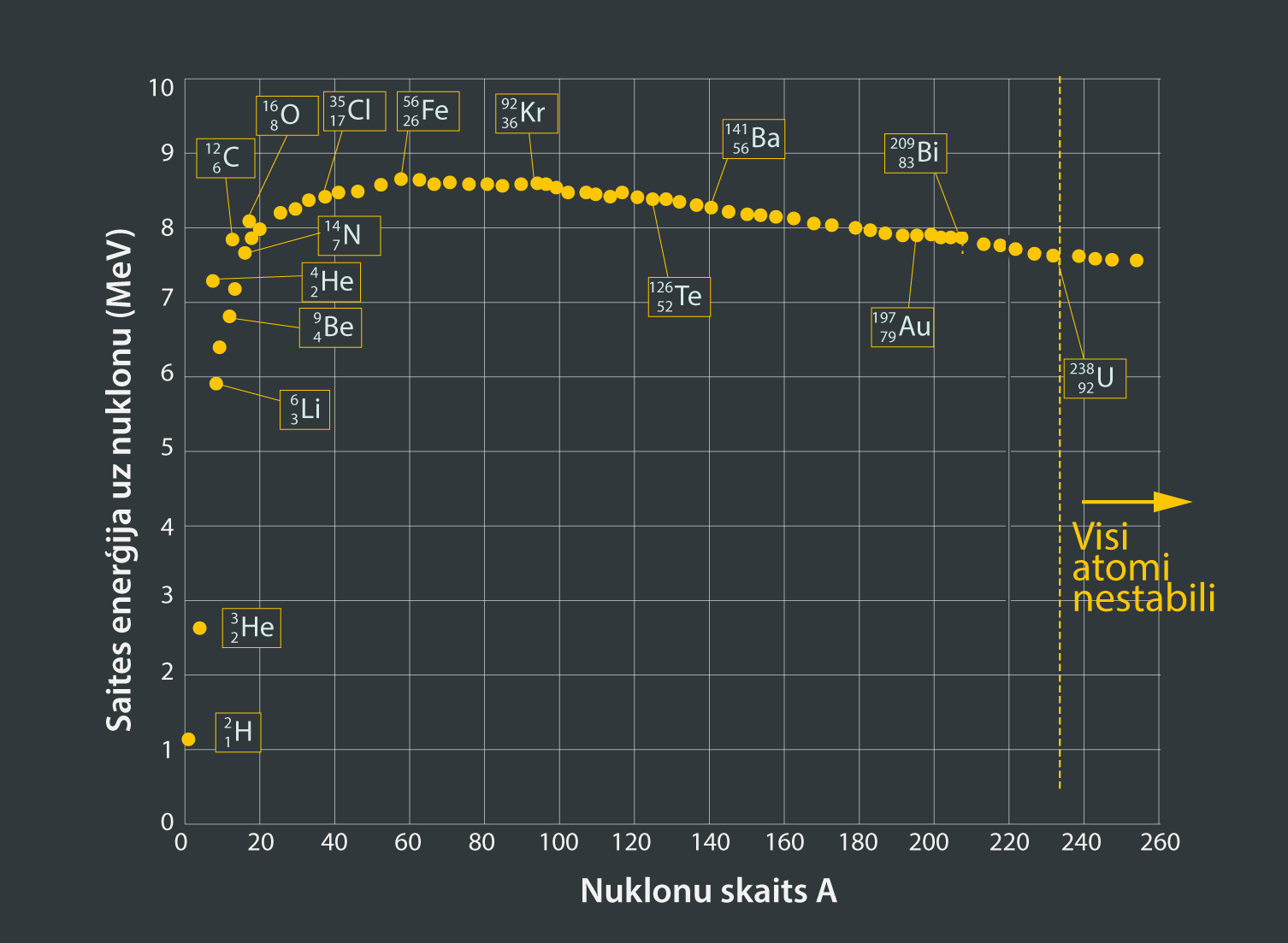
4.att. Atomu kodolu īpatnējā saites enerģija uz vienu nuklonu
Kodola saites enerģija un līdz ar to arī stabilitāte ir saistīta ar protonu un neitronu skaita attiecību kodolā. Pastāv tikai noteiktas protonu un neitronu skaita kombinācijas, pie kurām izveidojas stabili kodoli. Ja grafikā, kurā uz x ass ir protonu skaits Z, bet uz y ass ir neitronu skaits N, ar zaļu krāsu iezīmē apgabalus, kas atbilst stabila kodola protona un neitrona skaita kombinācijām, iegūst 5. attēlā redzamo ainu. Ar sarkanu krāsu šajā grafika ir iezīmēta nestabilo kodolu zona. Nestabili ir tādi kodoli, kurus ir iespējams iegūt, bet tie nedzīvo ilgu laiku un drīz vien sabrūk. Grafikā ļoti uzskatāmi parādās tas, ka stabilos kodolos neitronu skaits parasti pārsniedz protonu skaitu, piemēram, zelta Au izotopam 19779 Au ir 79 protoni un 118 neitroni (5. att.).
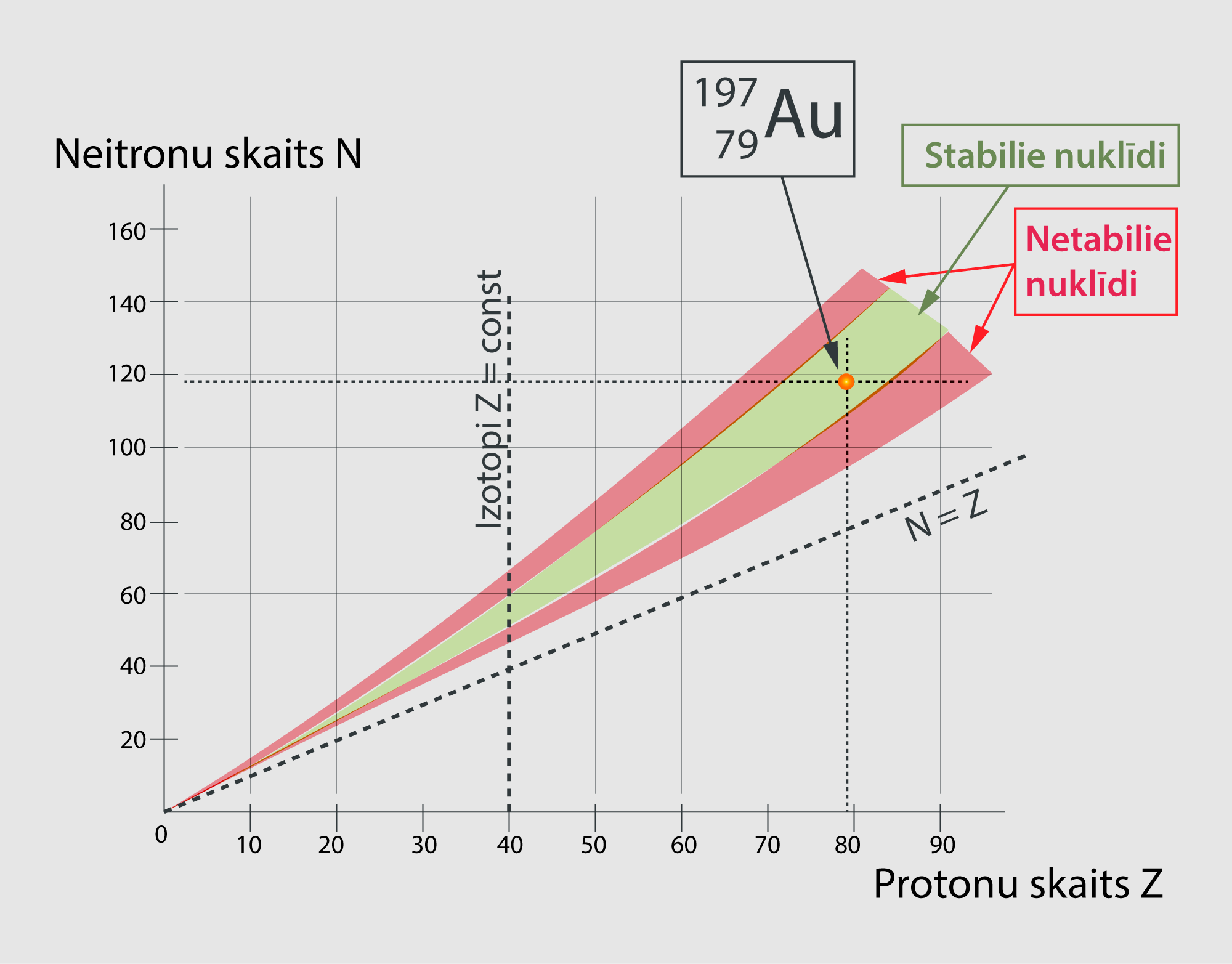
5.att. Nuklīdu karte
Lai sašķeltu dažādu atomu kodolus, ir nepieciešama enerģija. Izraisot kodolu dalīšanos, ir svarīgi zināt, cik liela enerģija ir nepieciešama kodola sadalīšanai. Šajā uzdevumā lietderīga ir slavenā Einšteina formula E = mc2 .(1. att.), kur
E – miera stāvokļa enerģija, J
m – miera stāvokļa masa, kg
c – gaismas ātrums vakuumā, m/s
Šī formula noteic to, ka jebkurai mierā esošai masai var piekārtot ekvivalentu (atbilstošu) enerģijas daudzumu. Paliek tikai jautājums, kur kodolā sastopama šī masa, kas atbilst saites enerģijai, jo pašus noklonus sadalīt nevar, līdz ar to nuklonu masa tā nav.

1.att. Einšteina slavenā formula
Izrādās, ka atbilde slēpjas tā sauktajā masas defektā, kas piemīt kodolam. Par masas defektu sauc parādību, kad atsevišķu nuklonu kopējā miera masa ir lielāka par atoma kodola masu, ko veido šie nukloni (2. att. a). Šajā masas starpībā Δm arī slēpjas kodola saites enerģija, kas jāpievada, lai kodolu sašķeltu. Piemēram, no 6 protoniem un 6 neitroniem sastāvošā oglekļa -12 (12C) kodola masa m1 = 11,00857 u, kur u ir atommasas vienība. Viena protona miera masa mp = 1,00728u, bet neitrona miera masa mn = 1,00857u. Aprēķinot 6 protonu un 6 neitronu kopējo miera masu (2. att. b), iegūst m2 = 6 · mp + 6 · mn = 6 · 1,00728 + 6·1,00857= 12,0957 u. Masas defekts Δm = m2 - m1 = 12,0957 - 11,9967 = 0,0990 u. Viena atommasas vienība u = 1,6605 · 10-27kg, līdz ar to masas defekts Δm = 0,0990 · 1,6605 · 10-27 = 1,6439 · 10-28kg. Pēc Einšteina formulas E = Δmc2 = 1,6439 · 10-28 · (3 · 108)2 = 1,48 · 10-11J, kur c ≈ 3 · 108m/s. Tas nozīmē, ka viena 12C kodola sašķelšanai nepieciešama enerģija E = Δ1,48 · 10-11J.
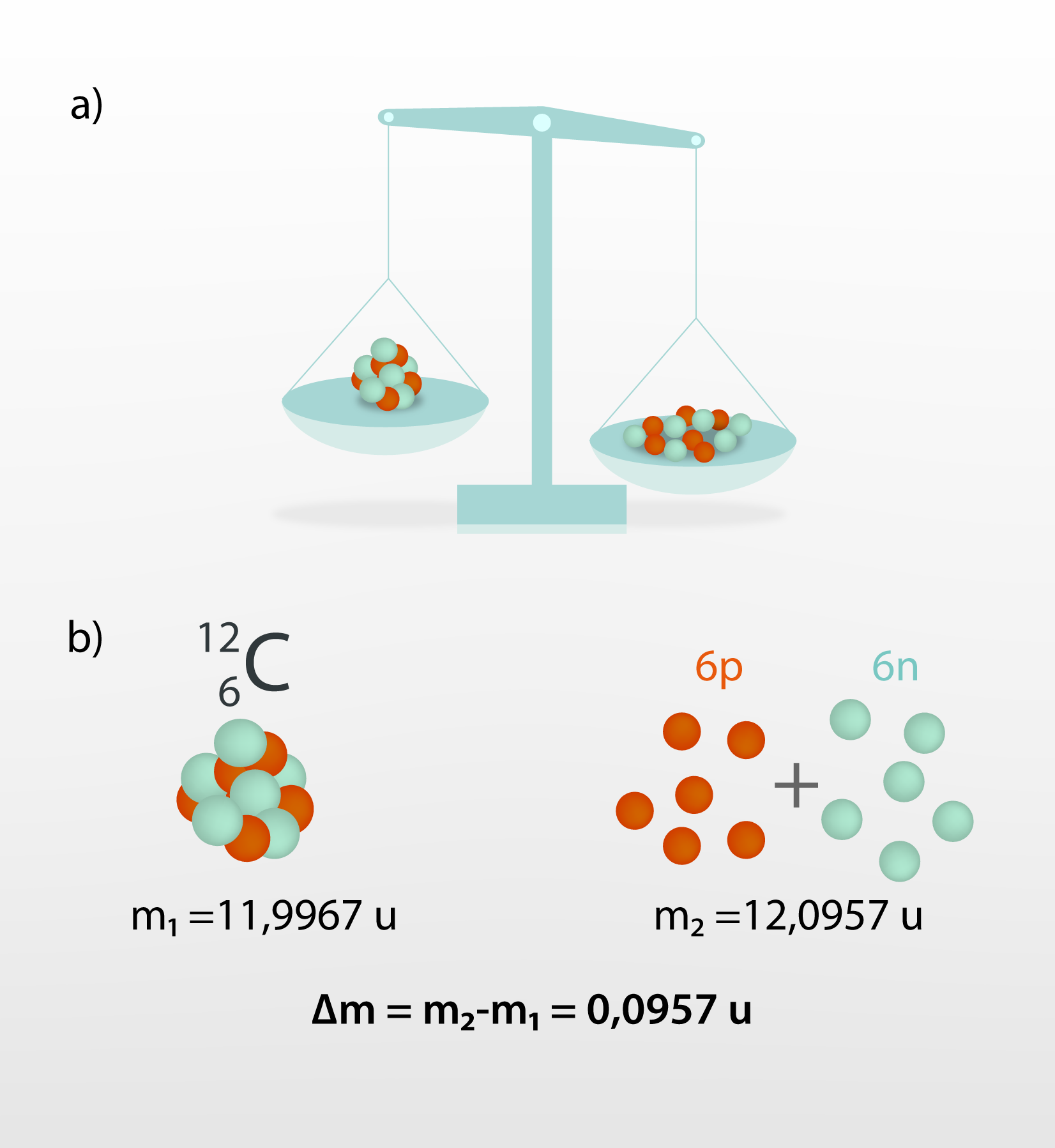
2.att. Masas defekts
Rakstot kodolreakciju vienādojumus, ir svarīgi parādīt to, kā izmainās nuklonu skaits dažādu elementu kodolos, tādēļ šādos gadījumos lieto 1. soļa 3. attēlā redzamo elementa apzīmēšanas sistēmu. Apskatot ķīmisko elementu periodisko tabulu, paveras nedaudz cita aina, jo tur elementam augšpusē tiek norādīts kārtas numurs jeb protonu skaits kodolā, bet apakšpusē relatīvā atommasa (3. att.). Tomēr pirmajā brīdī ir grūti aptvert, ko īsti norāda relatīvā atommasa, jo ir zināms, ka ūdeņradim atoms sastāv no viena elektrona un viena kodolā esoša protona, bet norādītā atommasa ir nedaudz lielāka par protona un elektrona kopējo masu. Tas ir tādēļ, ka, rēķinot relatīvo atommasu, ir ņemts vēra, ka dabā pastāv dažādi elementu izotopi. Piemēram, ūdeņradim ir zināmi trīs izotopi (1. solis 5. att.), no kuriem divi ir sastopami dabā. Norādītā ūdeņraža relatīvā atommasa (3. att.) ir vidējā ūdeņraža atommasa, ņemot vērā to, ka ūdeņraža izotops ar vienu protonu kodolā ir 99,985% no visa dabā sastopamā ūdeņraža, bet smagais ūdeņradis – deitērijs – dabā ir 0,015 %.
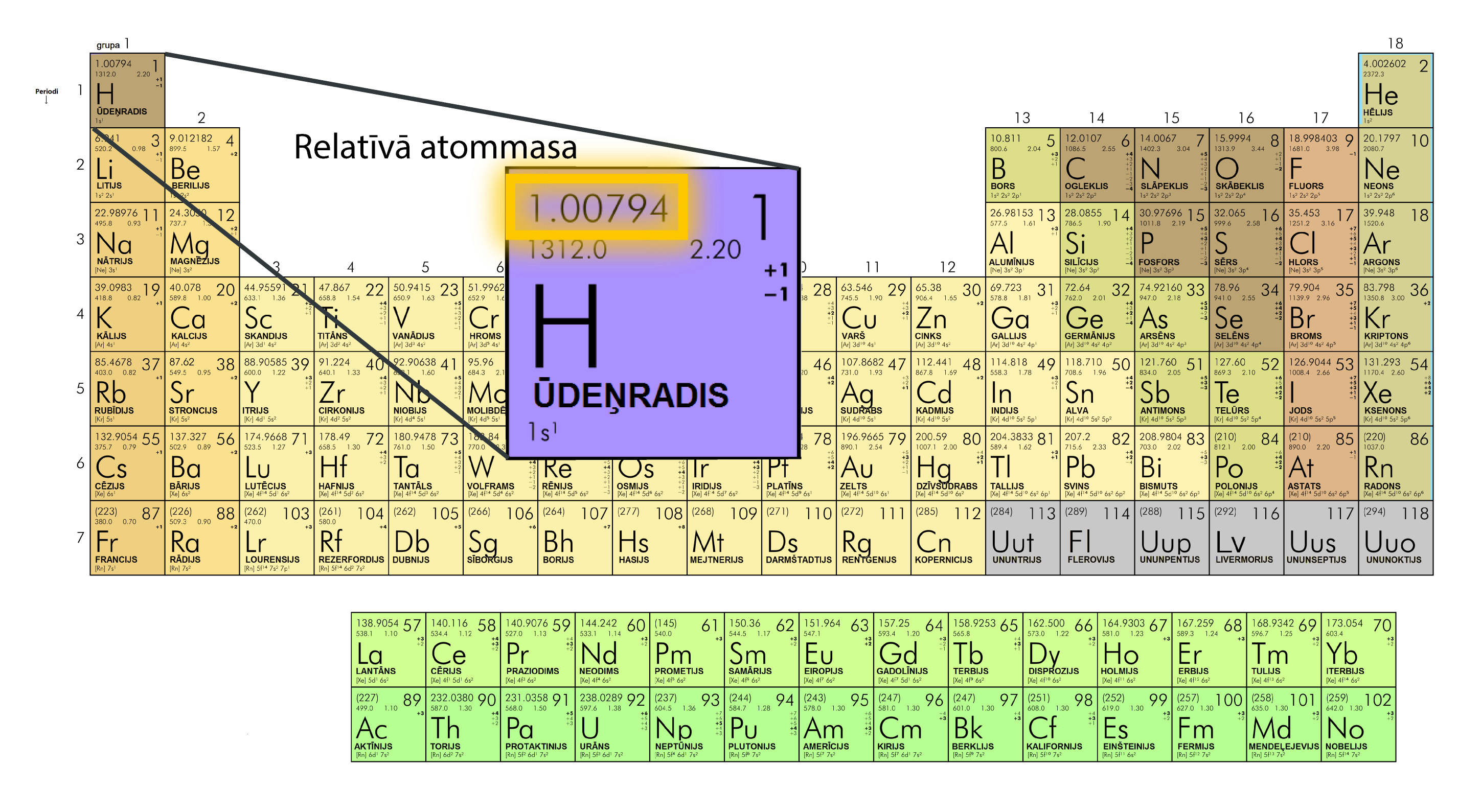
3.att. Relatīvā atommasa
Kodols var absorbēt un izstarot enerģiju EM starojuma veidā gluži kā atoms (Enerģijas emisija un absorbcija atomā), bet ar tādu atsķirību, ka kodola izstarotais EM starojumam ir lielāka frekvence un atbilstoši arī ar lielāka enerģija. EM viļņu skalā kodola starojumam atbilst gamma staru diapazons (EM viļņi un svārstības 1.soļa 5. att.). Protoni un neitroni kodolā, līdzīgi kā elektroni atomā (Enerģijas emisija un absorbcija atomā 2. soļa 1. att.), atrodas potenciālajā bedrē (4. att.), kurā tiem piemīt diskrēti enerģijas līmeņi, starp kuriem pārejot tiek absorbēts vai emitēts gamma kvants. Tā kā protona un neitrona masas atšķiras, atšķiras arī to enerģijas līmeņu izvietojums kodola potenciālajā bedrē (4. att.).
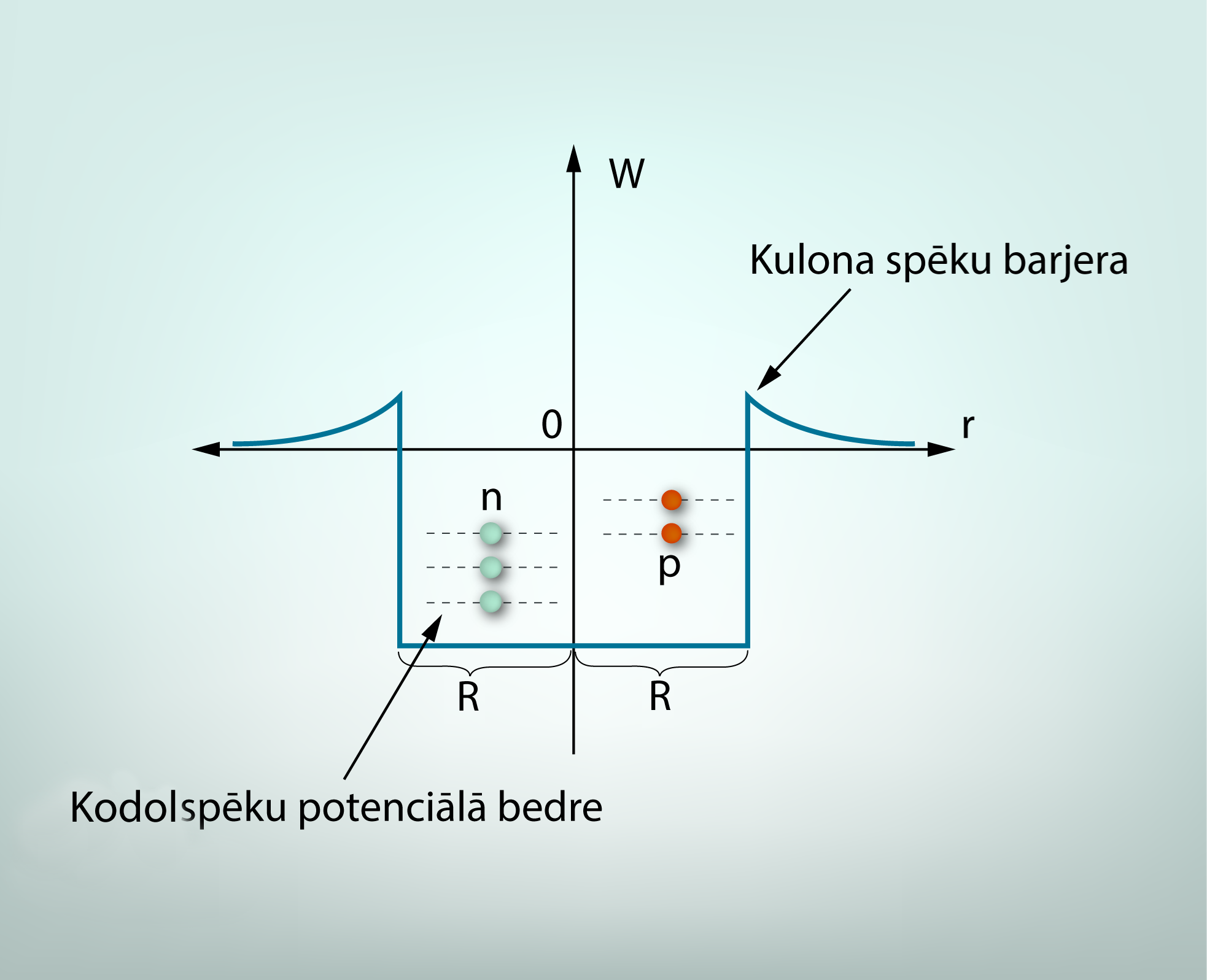
4.att. Protoni un neitroni kodola potenciālajā bedrē
Lienot arvien dziļāk atoma un kodola uzbūvē, mēs tik un tā vēl neesam tikuši līdz pašiem mazākajiem uzbūves elementiem, jo arī protonam un neitronam ir sava iekšējā uzbūve (5. att.). Protoni un neitroni ir veidoti no elementārdaļiņām, ko sauc par kvarkiem. Pastāv sešu veidu kvarki, no kuriem nuklonos sastopami divu veidu – u un d kvarki. Protons ir veidots no diviem u kvarkiem un viena d kvarka, bet neitrons – no diviem d kvarkiem un viena u kvarka (5. att.).
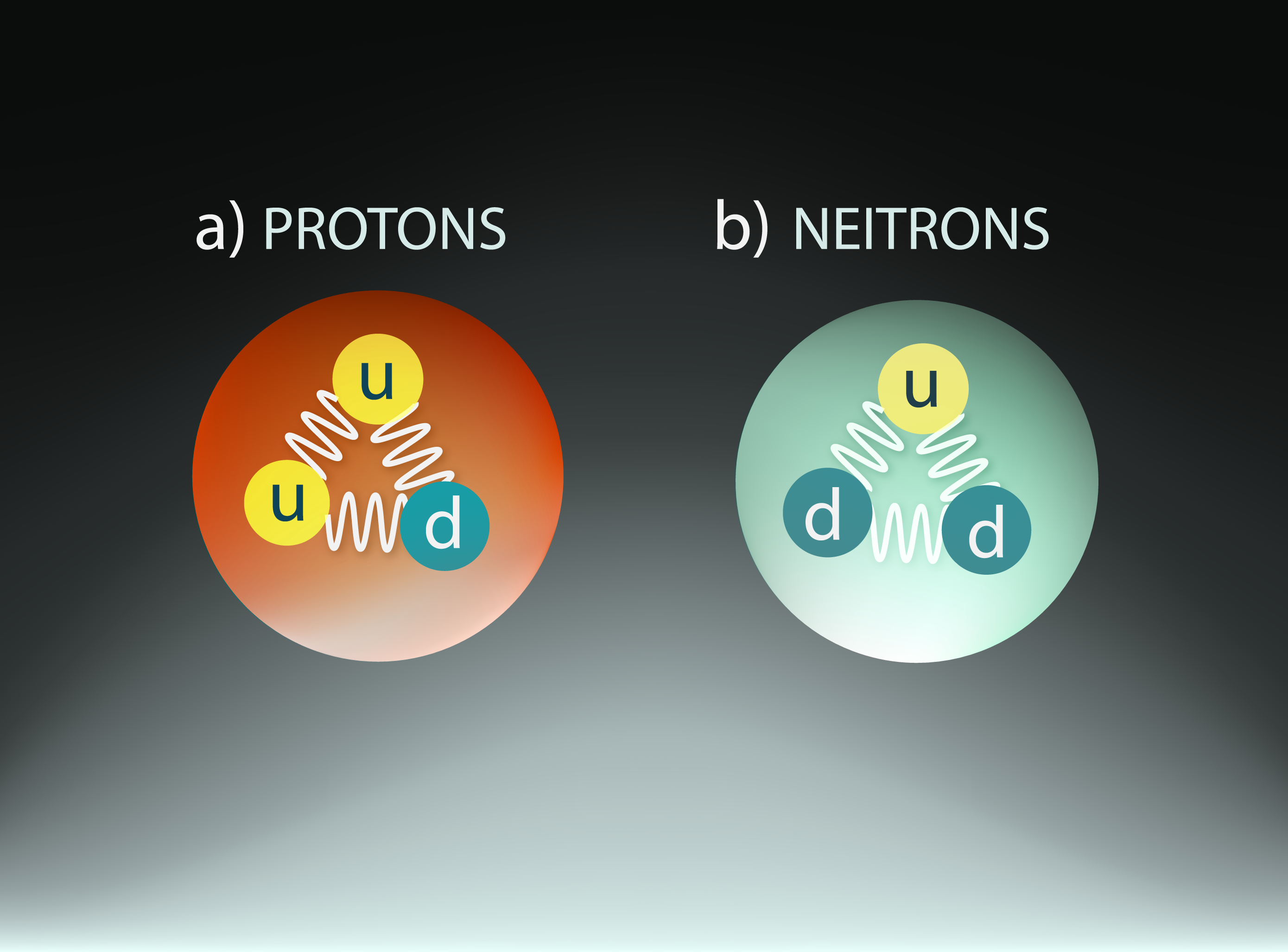
5.att. Protona un neitrona uzbūve
Līdztekus apjomīgajai atoma un kodola uzbūves elementu saimei apjomīgs ir arī izmēru diapazons, kuru šie elementi noklāj, sākot ar atoma izmēru, kas ir ap 10-10m, līdz pat kvarka un elektrona izmēriem, kuri ir mazāki par 10-18m (6. att.).
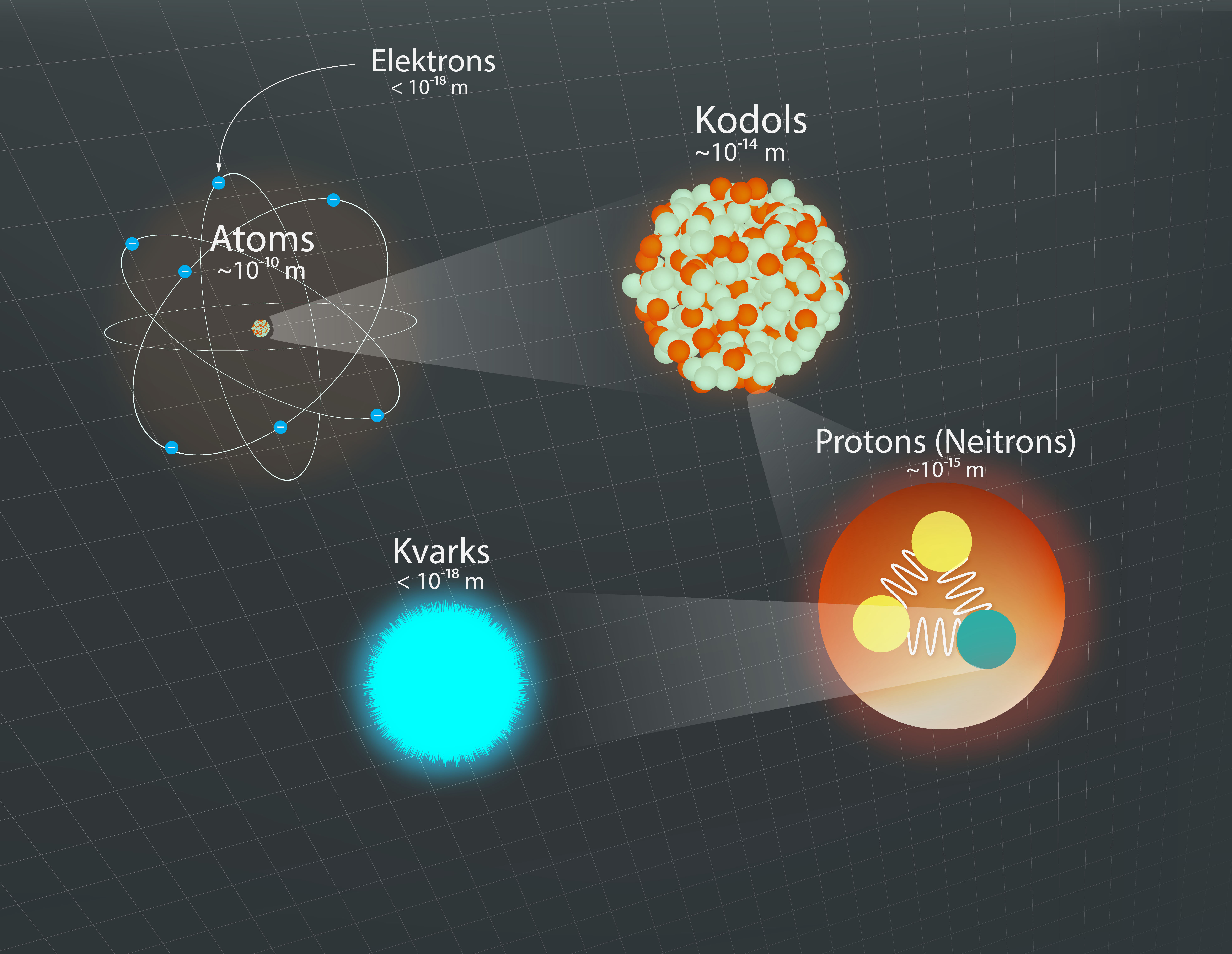
6.att. Dažādu atomu un kodolu veidojošu daļiņu izmēru hierarhija