Sadaļā par atoma uzbūvi tika noskaidrots, ka atomā elektrons var atrasties diskrētos enerģijas līmeņos (1. att. a). Šie enerģijas līmeņi ataino elektrona potenciālo enerģiju, kas veidojas gan kodola un elektronu, gan arī elektronu savstarpējās mijiedarbības un ārēju faktoru ietekmē. Šos enerģijas līmeņus var salīdzināt ar kāpņu pakāpieniem. Uz katra pakāpiena cilvēkam ir atšķirīga potenciālā enerģija (1. att. b). Līdzīgi kā cilvēka pēdas var atrasties tikai uz kāpņu pakāpieniem, nevis kaut kur starp tiem, tāpat arī elektrons var atrasties tikai diskrētajos enerģijas līmeņos un nekur citur.
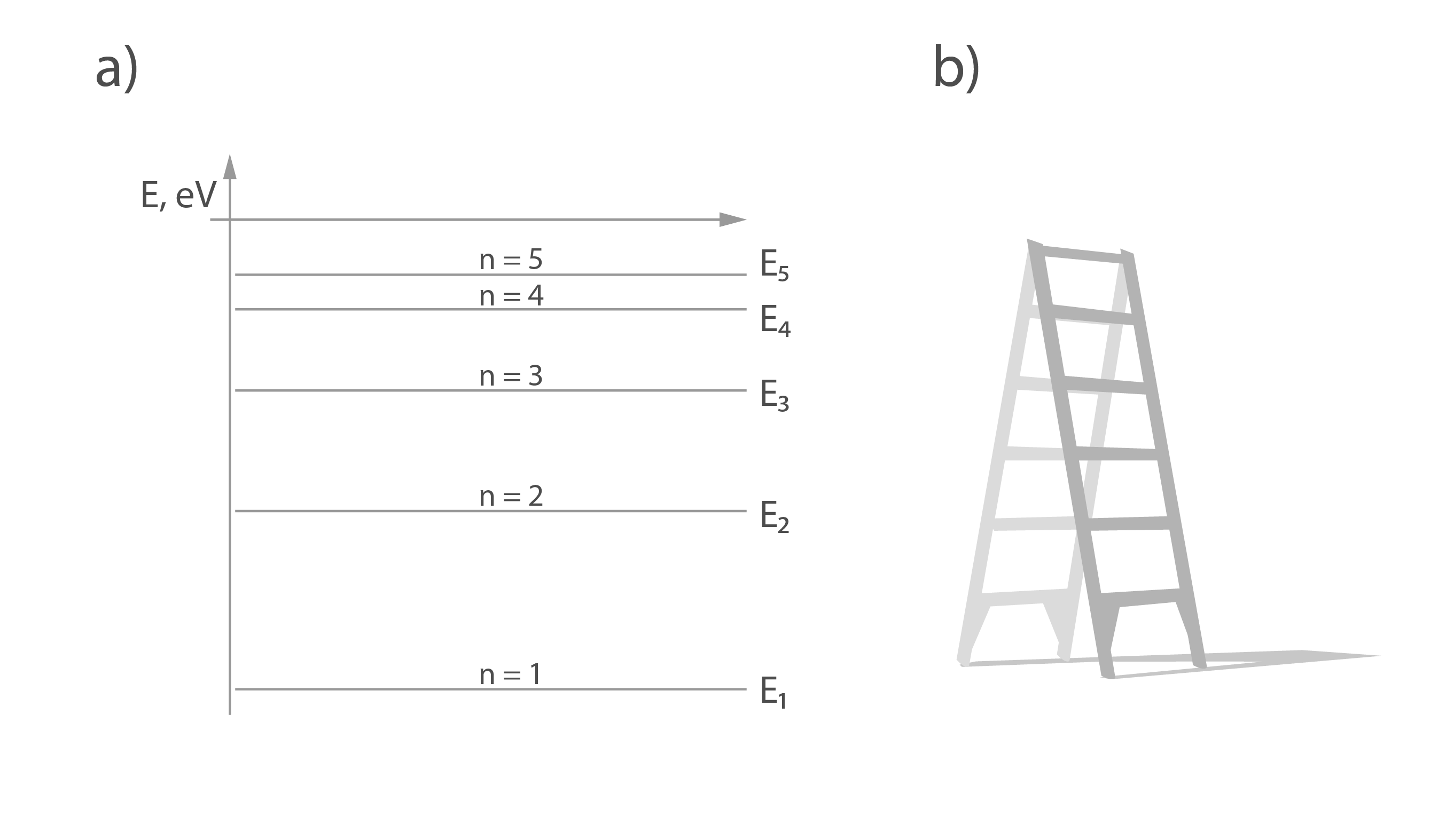
1.att. Atoma enerģijas līmeņi
Lai atoms pārietu no zemāka enerģijas līmeņa uz augstāku, ir nepieciešama enerģija, kas vienāda ar enerģijas starpību starp šiem līmeņiem. Piemēram, lai elektronu no līmeņa, kura enerģija ir W1, pārvietotu uz līmeni ar enerģiju W2, nepieciešamais enerģijas daudzums ir W2 – W1(2. att. a). Sadaļā par gaismas kvantiem tika noskaidrots, ka gaismas kvanta enerģija E = hν, kur
ν – starojuma frekvence, Hz
h – Planka konstante, J·s
Lai atoms pārietu no līmeņa ar enerģiju W1un līmeni ar enerģiju W2, ir nepieciešams EM starojums ar tādu frekvenci, lai tā kvanta enerģija sakristu ar enerģijas starpību starp līmeņiem, tādēļ jāizpildās sakarībai W2– W1 = hν. Ja sakarība izpildās, tad, laižot uz atoma šādu EM starojumu, atoms to absorbē un elektrons no stāvokļa W1nonāk stāvoklī W2. Aprakstītā situācija atomā ir līdzīga ar cilvēka kāpšanu pa kāpnēm un tā potenciālo enerģiju. Ja cilvēks atrodas uz apakšējā pakāpiena un grib nokļūt uz augšējā pakāpiena (2. att. b), tad cilvēka potenciālā enerģija pieaug, un šī enerģija kaut kur ir jāpaņem.
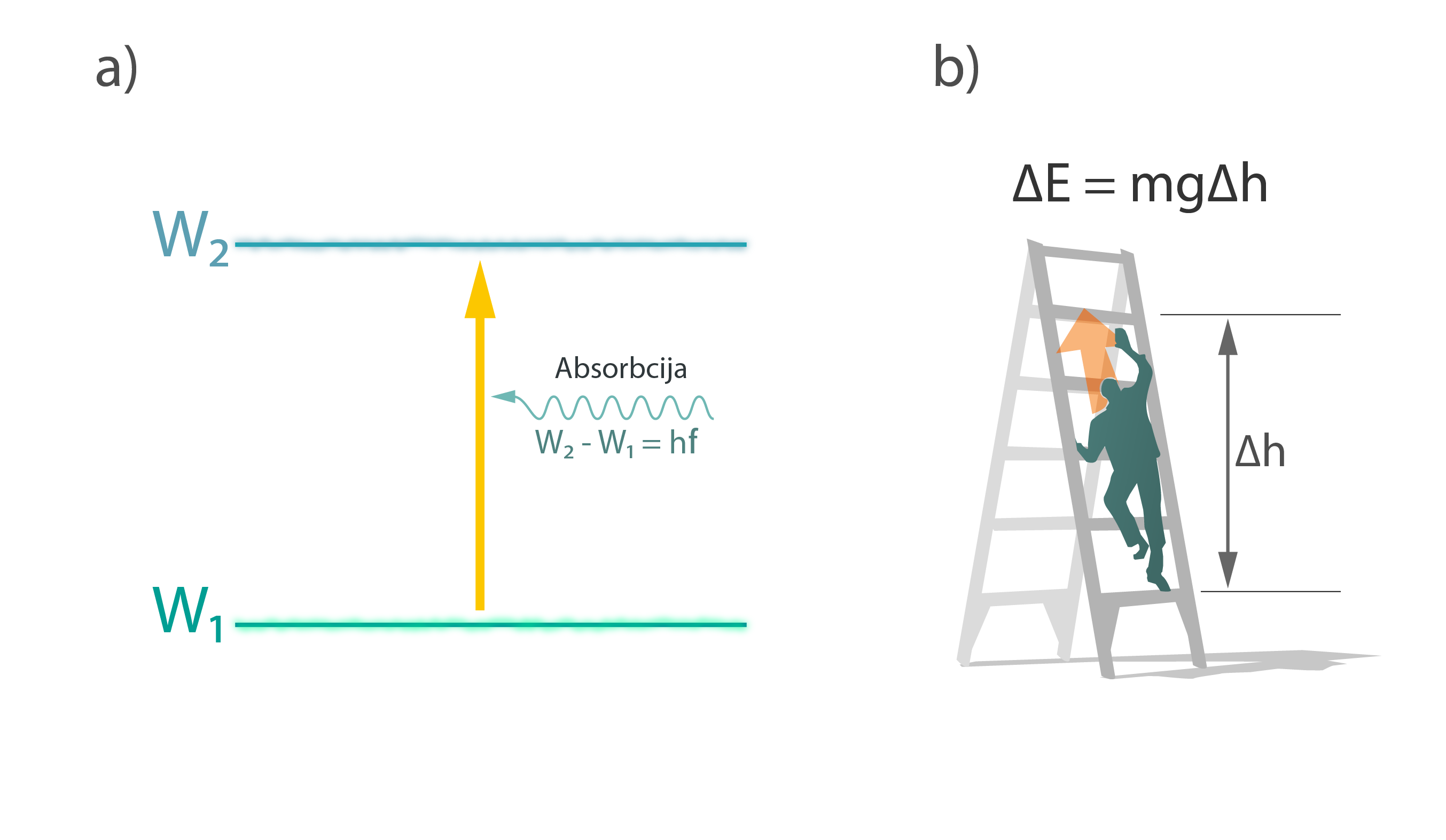
2.att. EM starojuma absorbcijas atomā
Atomā var notikt arī pretējais process. Ja elektrons atrodas augstākā enerģijas līmenī W2, tad tas var nonākt zemākā enerģijas līmenī W1. Šādā gadījumā EM starojuma kvants tiek izstarots un tā frekvence atbilst tādai kvanta enerģijai, kas sakrīt ar enerģijas starpību starp enerģijas līmeņiem (3. att. a). Šādu atoma starojumu sauc par spontānu, jo tas notiek neatkarīgi no kādiem ārējiem apstākļiem. Līdzīga situācija ir ar cilvēku, kas uzkāpis uz kāda augšējā kāpņu pakāpiena un grib tikt lejā. Šādā gadījumā tam nav vajadzīga enerģija no ārpuses, tas izmanto potenciālo enerģiju, kas ir uzkrāta (3. att. b).
Apskaties DZM materiālu par šo tēmu!
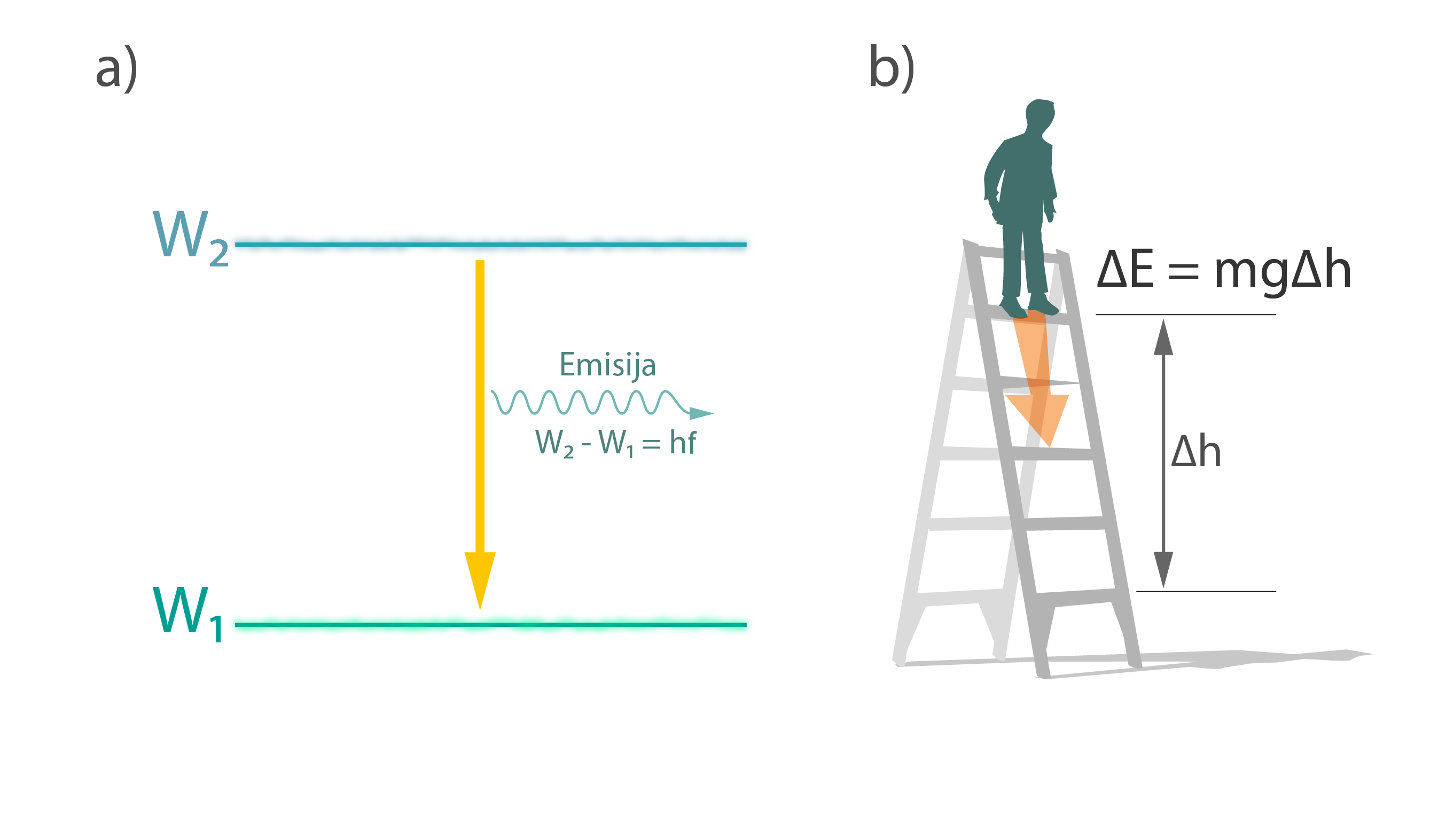
3.att. EM starojuma emisija atomā
Dažādiem atomiem enerģijas līmeņi ir atšķirīgi izvietoti, tādēļ atšķiras enerģijas starpība starp šiem līmeņiem. Tas nozīmē, ka dažādu atomu izstarotā vai absorbētā gaisma ir kā pirkstu nospiedumi, kas atšķir dažādu veidu atomus. Šos atomu “pirkstu nospiedumus” var iegūt, izmantojot spektrometrus, un tālāk, analizējot iegūtos spektrus (4. att.), var noteikt, gan no kādiem atomiem šī gaisma ir nākusi, gan arī apstākļus, kādos šie atomi atrodas, piemēram, temperatūru un spiedienu.
Skaties cita veida materiālu par starojuma spektriem!
4.att. Daļa no dzelzs tvaiku emisijas spektra
Enerģijas līmeņus atomā var sanumurēt, izmantojot galveno kvantu skaitli n. Zemākās enerģijas līmeni sauc par pamatstāvokli, un tā galvenais kvantu skaitlis n = 1 (1. att. a). Pārējie ir ierosinātie stāvokļi, un attiecīgi to galvenie kvantu skaitļi ir n = 2, 3, 4 … . Līmeņu enerģijas piekārto tā, ka visaugstākajam līmenim enerģija ir 0, un tad attiecīgi zemāku līmeņu enerģijas ir ar mīnusa zīmi. Tas ir līdzīgi kā situācija, kad par potenciālās enerģijas nulles līmeni pieņem Zemes virspusi, bet tad iznāk iekrist bedrē, kurā attiecībā pret nulles līmeni potenciālā enerģija ir ar mīnusa zīmi (1. att. b). Var teikt, ka elektroni atomā atrodas potenciālajā bedrē. Visvienkāršākais no atomiem ir ūdeņraža atoms, un tam līmeņu enerģijas var aprēķināt, izmantojot formulu En = -13,61 : n2, kur nir galvenais kvantu skaitlis.
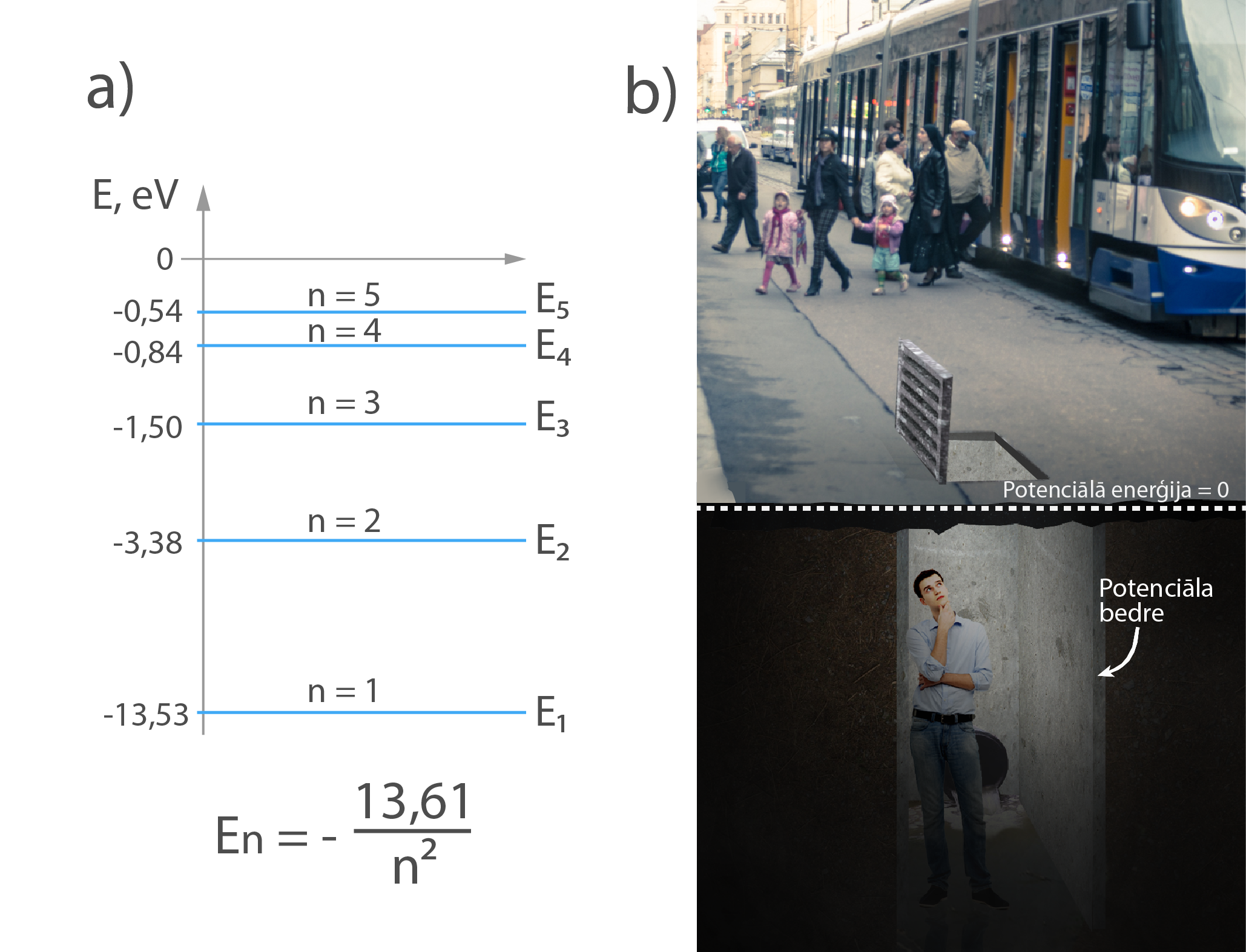
1.att. Ūdeņraža līmeņu enerģijas un potenciālā bedre
Elektronam, pārejot no kāda augstāka enerģijas līmeņa uz zemāku, veidojas ūdeņraža emisijas spektrs (2. att.). Šo spektru var sadalīt sērijās. Ja pāreja notiek no ierosinātajiem stāvokļiem uz pamatstāvokli, kuram galvenais kvantu skaitlis n = 1, tad sēriju sauc par Laimena sēriju. Par Balmera sēriju sauc spektrālās līnijas, kas veidojas pārejā uz līmeni ar galveno kvantu skaitli n = 2. Šīs sērijas spektrālās līnijas atrodas redzamajā EM viļņu diapazonā. Attiecīgi tālākās sērijas sauc par Pašena, Breketa un Pfunda sērijām (2. att.).
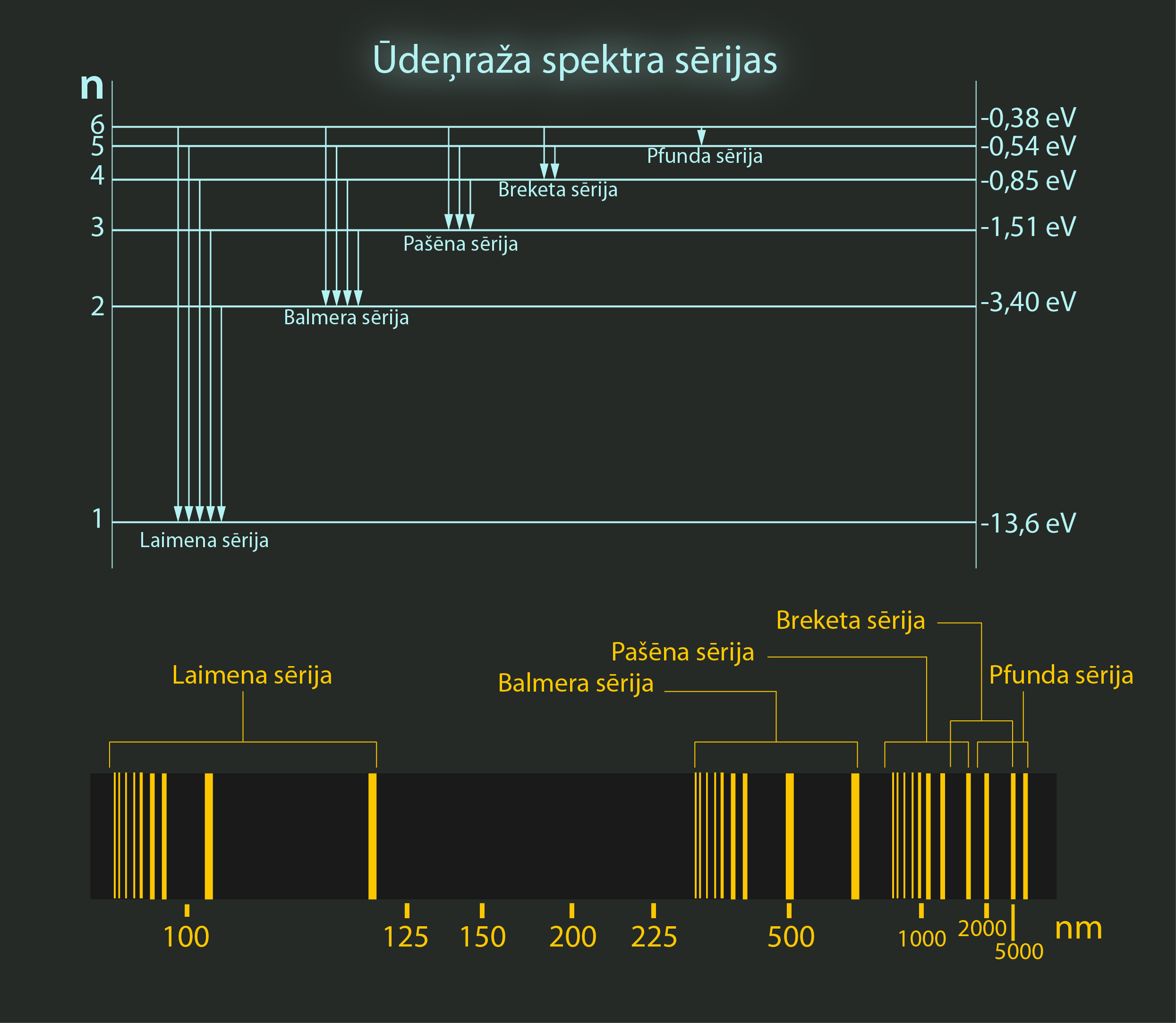
2.att. Ūdeņraža spektra sērijas
Pastāv vairāku veidu spektri. Piemēram, elektriskā spuldze izstaro nepārtrauktu spektru (3. att. a). Tas nozīmē, ka spuldzes izstarotā gaisma sastāv no visiem redzamās gaismas viļņu garumiem. Nepārtrauktus spektrus izstaro sakarsētas cietas vielas un šķidrumi, jo tajos esošajiem atomiem ir bezgalīgi daudz iespējamo enerģijas līmeņu. Arī Saule izstaro nepārtrauktu spektru (3. att. b).
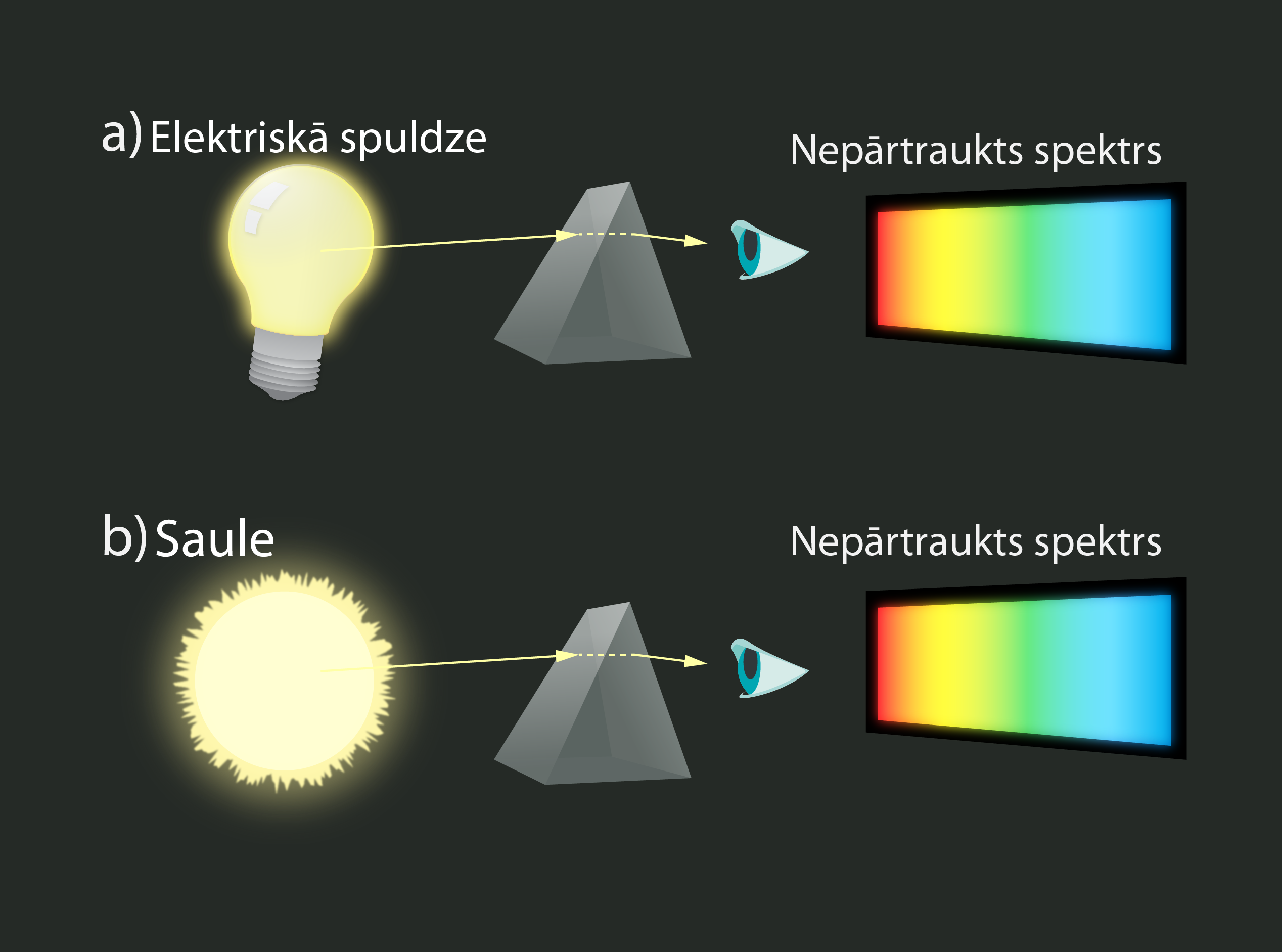
3.att. Nepārtraukts spektrs
Ja spektrs sastāv no līnijām, tad to sauc par līnijspektru (4. att.). Līnijspektrs veidojas, piemēram, jau minētajā ūdeņradī, kad spektrā redzamas konkrētas pārejas starp enerģijas līmeņiem. Viena spektrālā līnija ir pāreja starp diviem enerģijas līmeņiem. Līnijspektri var būt emisijas un absorbcijas. Emisijas spektrs veidojas tad, kad avots ir uzkarsēts. Arī siltuma enerģija ir enerģija, līdz ar to uzkarsētam avotam ir spējīgs izstarot atsevišķu frekvenču EM starojumu, veidojot līnijspektru (4. att. a). Ja spektra avots ir auksts, tad tas labprātāk enerģiju uzņem nekā atdod. Laižot uz šādu aukstu avotu nepārtrauktu spektru no kāda gaismas avota, šajā spektrā parādās melnas līnijas (4. att. b). Līnijas norāda avota "apēsto" gaismu. Viena no tā paša avota emisijas un absorbcijas spektra līnijas sakrīt (4. att. a,b), jo avots var absorbēt vai emitēt tikai tādas frekvences EM starojumu, kura enerģija atbilst enerģijas starpībai starp līmeņiem.
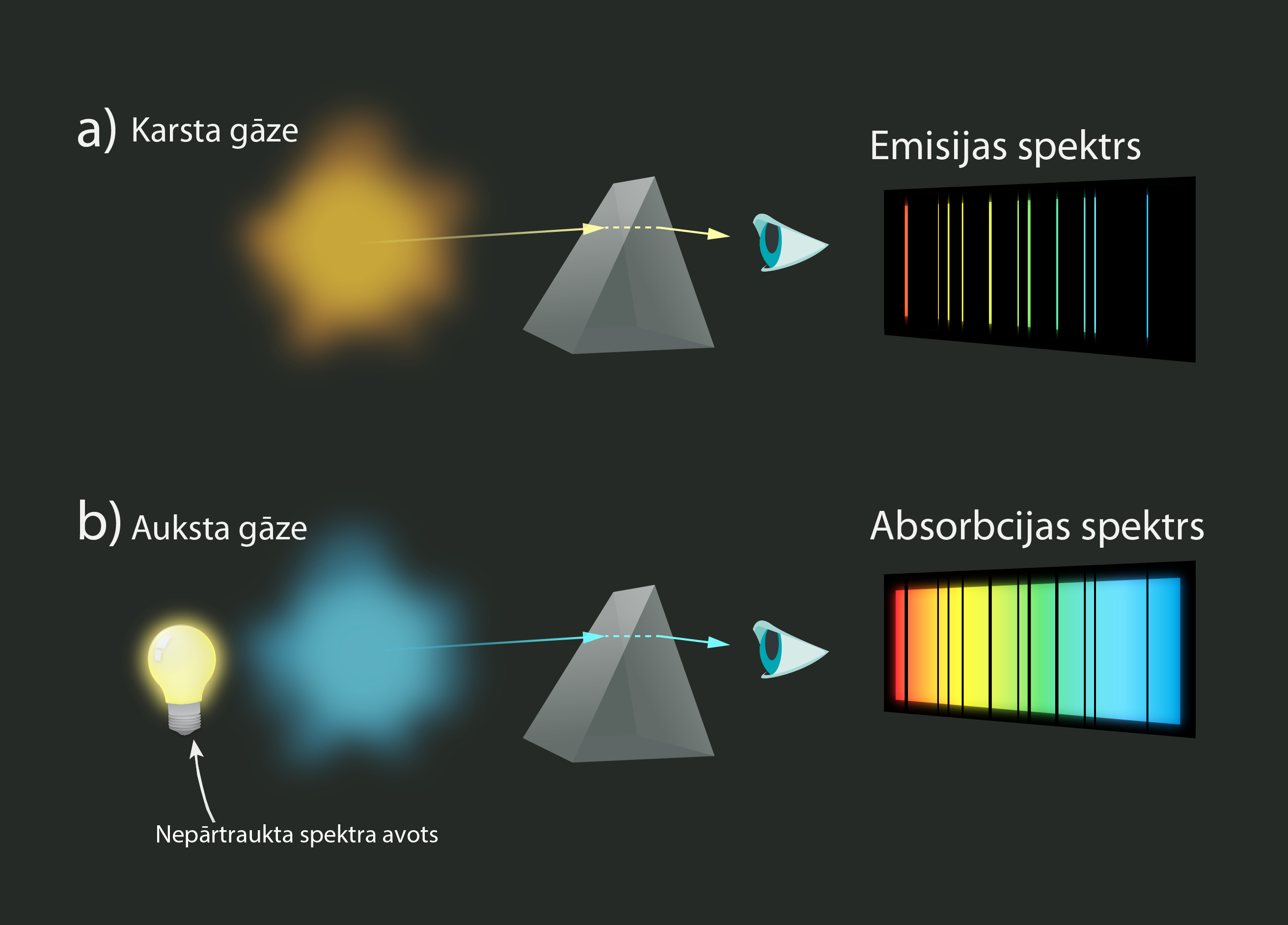
4.att. Emisijas un absorbcijas līnijspektrs
Dažiem elementiem ir raksturīgas spektrālās līnijas, pēc kurām šos elementus ir viegli atpazīt. Piemēram, nātrija spektram ir raksturīgas divas ļoti tuvu stāvošas dzeltenas līnijas, ko sauc par nātrija dubletu (5. att. a). Tā kā nātriju izmanto apgaismošanas spuldzēs, tad šādu spuldžu izstarotā gaisma ir dzeltenīgā krāsā un līdz ar to šo spuldžu apgaismotās vietas ir ietītas dzeltenīgā nokrāsā (5. att. b).
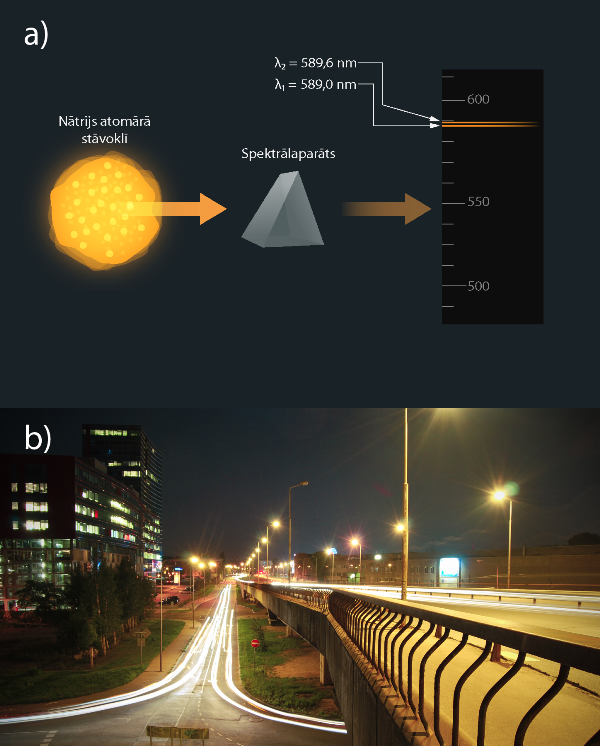
5.att. Nātrija spektram raksturīgās līnijas un to izpausme sadzīvē
Tātad nātrija emisijas spektrs sastāv no divām izteiktām dzeltenām spektra līnijām (6. att. a) un kā jau tika minēts iepriekš, ja tiktu uzņemts nātrija absorbcijas spektrs, tad tas sastāvētu no divām tumšām līnijām, kuras atrastos tieši tajā pašā vietā, kur emisijas līnijas (6. att. b).
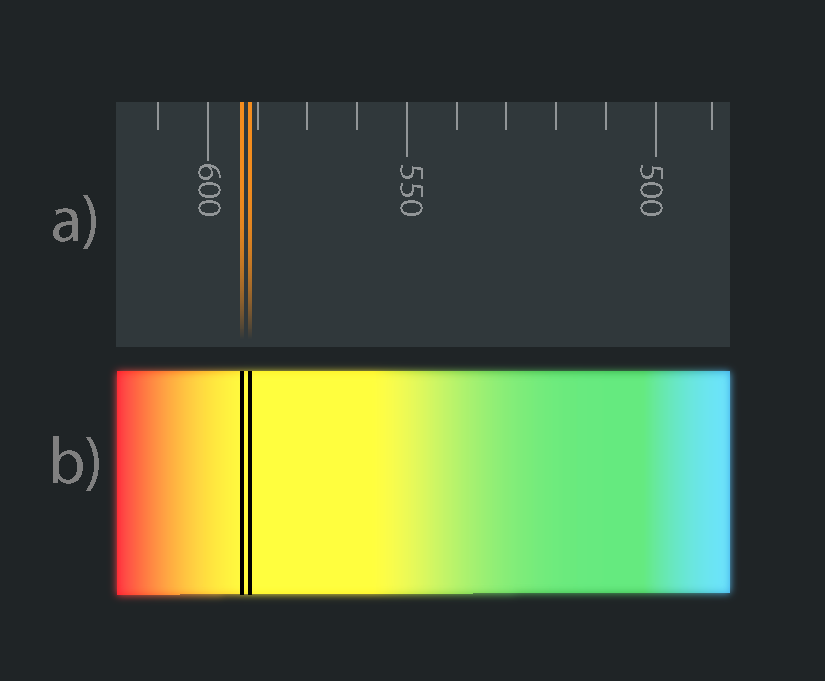
6.att. Nātrija emisijas un absorbcijas spektrs
Analizējot avota spektru, svarīgi ir ne tikai tas, vai kādas krāsas gaisma spektrā ir vai nav, bet arī tas, cik liels gaismas stiprums ir katras krāsas gaismai. Piemēram, baltās gaismas LED spuldzes starojumā ir sastopami visi redzamās gaismas viļņu garumi, bet 7. attēlā redzams, ka zilās un zaļganās krāsas gaisma ir intensīvāka par pārējām krāsām.
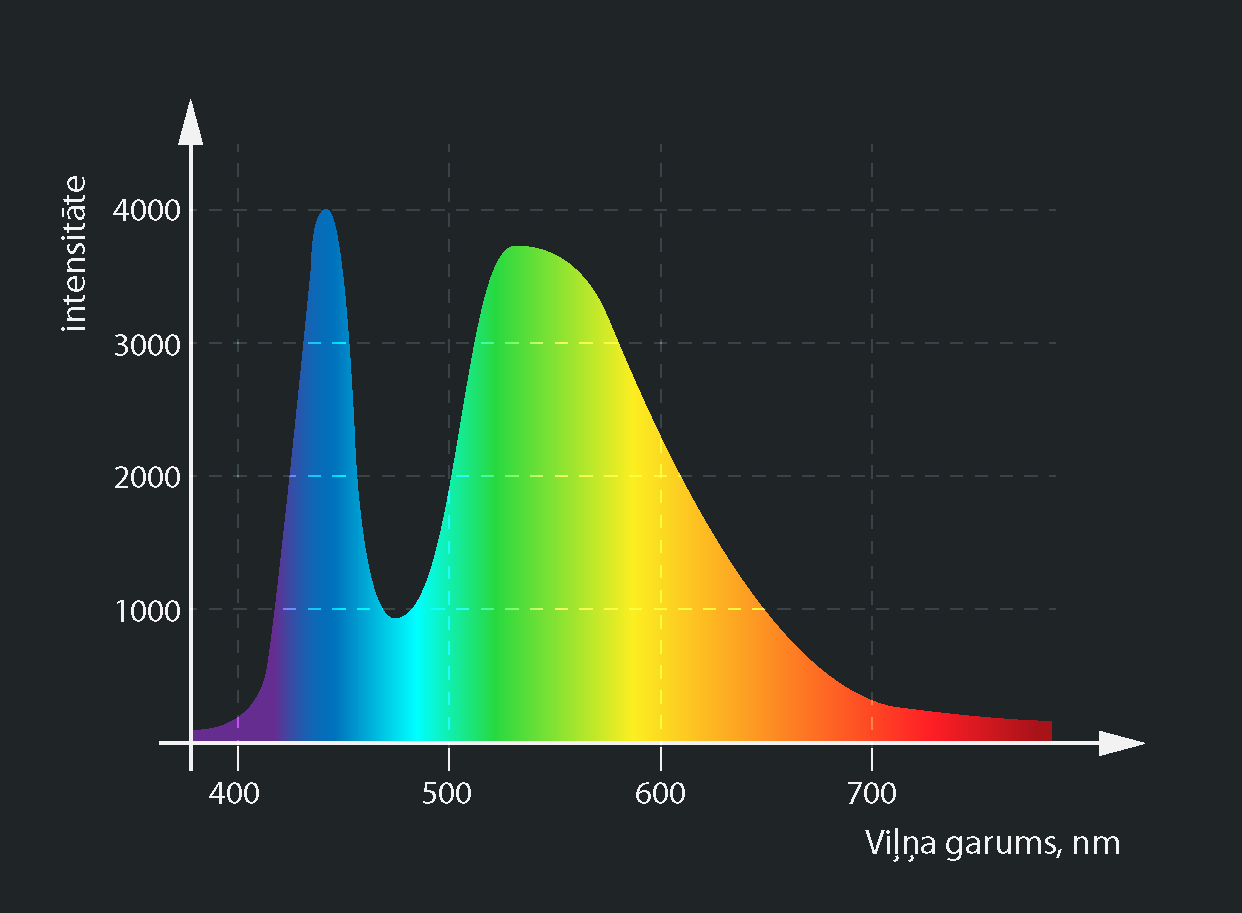
7.att. Baltās gaismas LED spuldzes spektrs
Ja divos enerģijas līmeņos E1 un E2 atrodas elektroni un šādas sistēmas virzienā krīt gaismas kvants, kura enerģija sakrīt ar enerģijas starpību starp dotajiem līmeņiem, tad, ņemot vērā iepriekš apskatītos piemērus, liktos, ka gaismas kvants tiks absorbēts un elektrons no līmeņa E1 nonāks augstākajā līmenī E2. Tomēr noteiktos apstākļos var gadīties tā, ka krītošais gaismas kvants nevis paceļ elektronu no zemāka līmeņa uz augstāku, bet tieši otrādi, norauj lejā elektronu, kas atrodas uz augstāka līmeņa, tādā veidā radot papildu starojumu, ko sauc par inducēto starojumu (1. att.).
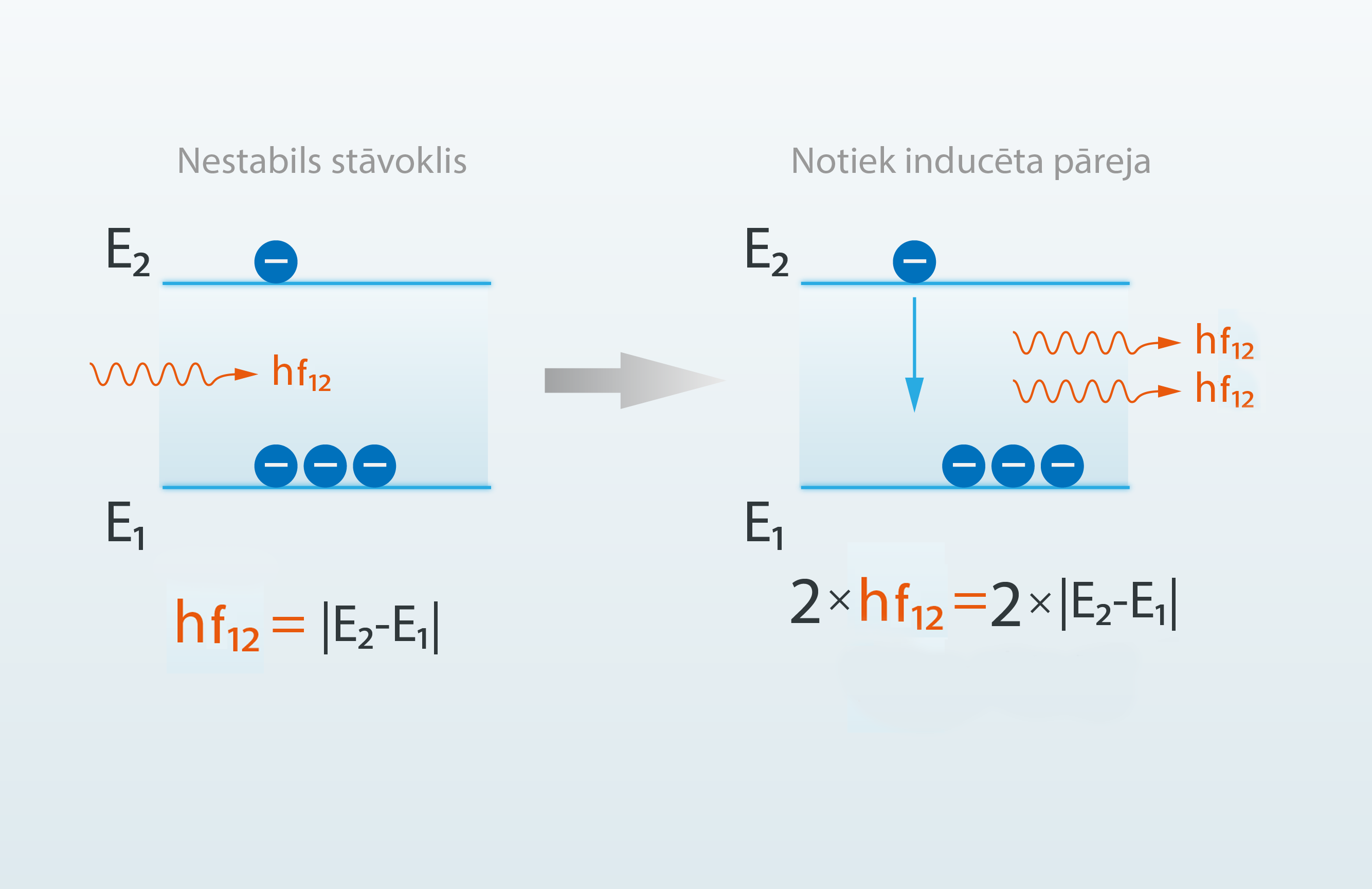
1.att. Inducētā starojuma veidošanās
Inducētajam starojumam ļoti strauji pieaug intensitāte, jo katrs inducētais kvants atsevišķi var inducēt atkal jaunus kvantus. Tā ir gluži kā lavīna, jo pirmā kvanta darbības rezultātā rodas divi kvanti, pēc tam divi radušies kvanti darbojas atsevišķi un rodas jau četri, pēc tam astoņi kvanti un tā tālāk (2. att. a). Inducētā starojuma piemērs ir plaši lietotie lāzeri, kuru starojums veidojas tieši inducētā starojuma rezultātā (2. att. b).
2.att. Inducēto kvantu lavīna
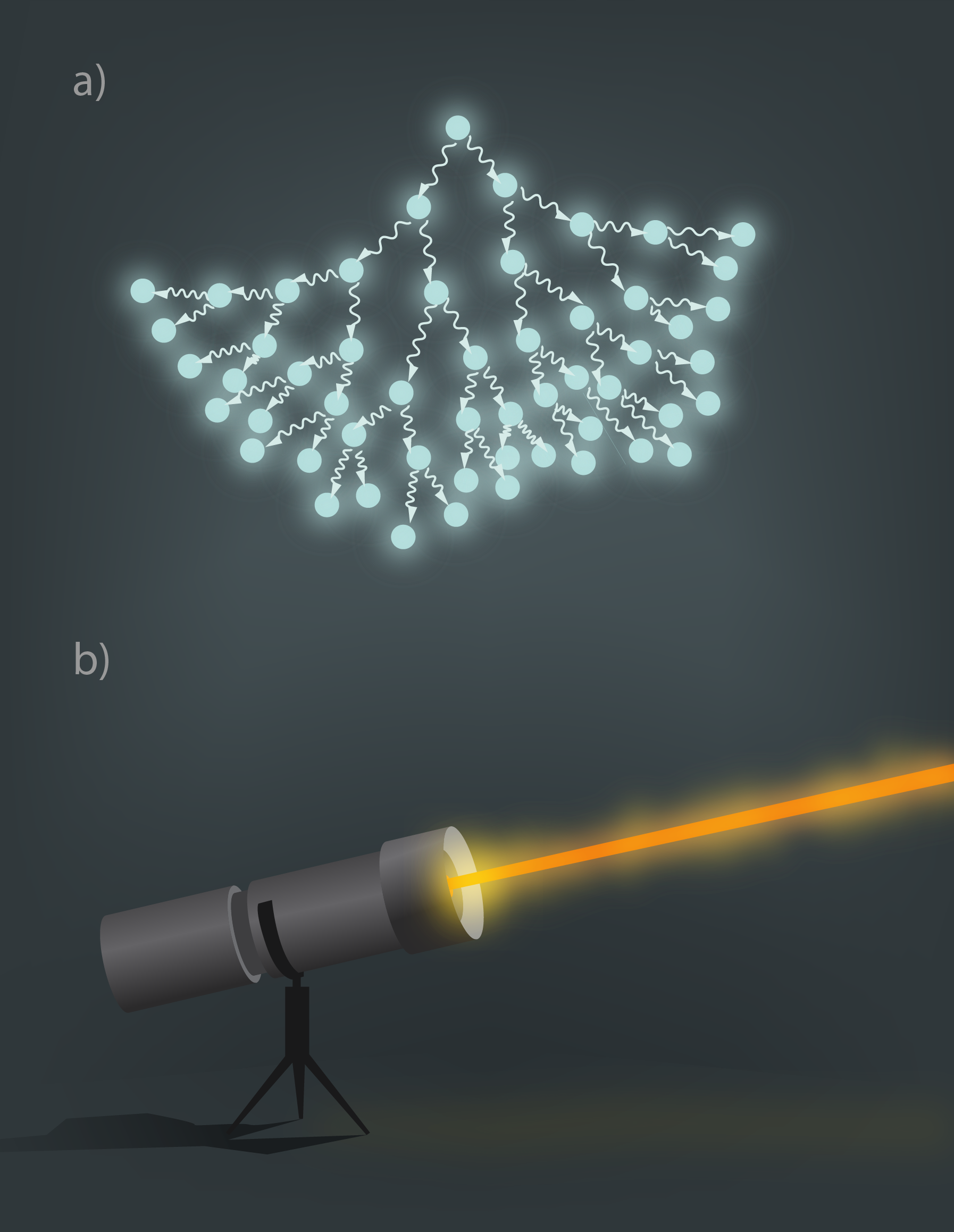
Lāzera starojumam ir ļoti konkrēts viļņa garums un līdz ar to arī starojuma kvanta enerģija, tādēļ šādu starojumu ir efektīvi lietot, ja ir vēlme atomā ierosināt elektronu pāreju starp konkrētiem enerģijas līmeņiem, kuriem ir zināma enerģijas starpība. Molekulās situācija ir sarežģītāka. Pretstatus vientuļam atomam, molekulā ir vismaz divi atomi, līdz ar to molekula atšķirībā no atoma var papildus gan svārstīties, gan rotēt, tādēļ molekulās ir krietni vairāk enerģijas līmeņu (3. att.). Tā kā ar molekulām mēs ikdienā sastopamies daudz vairāk nekā ar atomiem, tad ir ļoti svarīgi attīstīt molekulu izpētes metodes, tai skaitā molekulu īpašību analīzi, pamatojoties uz to emisijas un absorbcijas spektriem.
3.att. Molekulas enerģijas līmeņiem
Vienā no Latvijā esošajām pētniecības iestādēm, kas nodarbojas ar molekulu izpēti, ir Latvijas Universitātes Lāzeru centrs, kurā tiek izmantoti augstas klases lāzeri (4. att. a) un augstas izšķirtspējas spektrālie aparāti, lai iegūtu detalizētus molekulu spektrus (4. att. b), kurus apstrādājot un analizējot var iegūt detalizētu informāciju par molekulu uzbūvi.
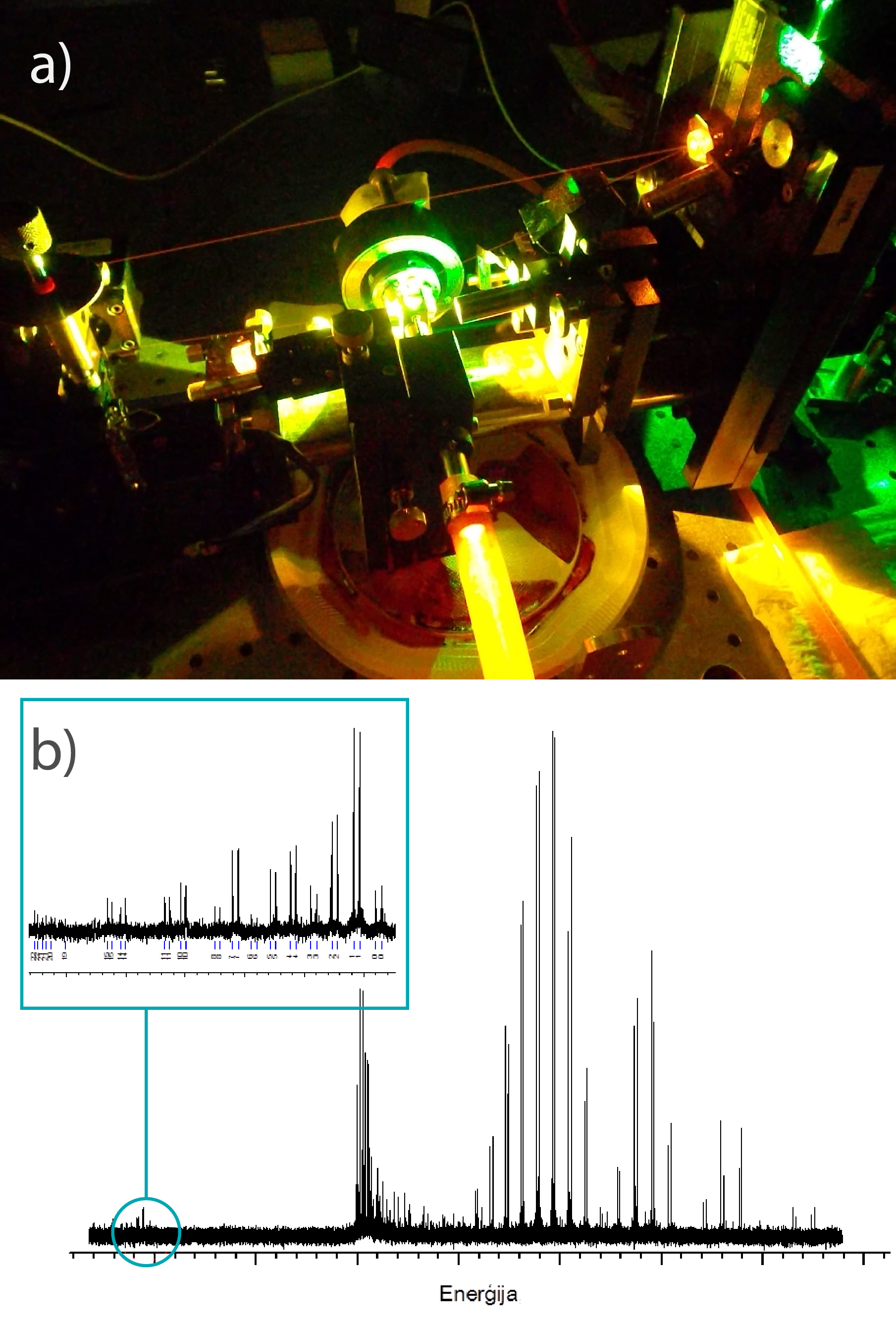
4.att. Krāsvielu lāzers un ar to iegūtais molekulu spektrs
Izmantojot spektroskopijas metodes, tiek pētītas ne tikai molekulas uz Zemes, bet arī izplatījumā esoša matērija. Savācot un veicot spektrālo analīzi gaismai, kas ir nākusi no kāda debess objekta, ir iespējams noteikt dažādus šī objekta fizikālos parametrus, piemēram, no kādām molekulām šis objekts sastāv, kāda ir tā temperatūra un cik ātri tas kustas attiecībā pret Zemi. Veicot šādas analīzes, Visumā ir atklāti ļoti interesanti objekti, piemēram, 463 miljardus kilometru plats mākonis, kurš sastāv no alkoholiskos dzērienos esošām molekulām (5. att.).

5.att. Visumā sastopami alkohola mākoņi